ธาตุ (Element) คือ สารบริสุทธิ์ที่ประกอบด้วยธาตุหรือสารชนิดเดียว ไม่สามารถแยกหรือสลายออกเป็นสารอื่นได้ อนุภาคที่เล็กที่สุดของธาตุเรียกว่า อะตอม ซึ่งประกอบด้วยอิเล็กตรอนวิ่งวนรอบนิวเคลียสที่ประกอบด้วยโปรตอน และ นิวตรอน
ตารางธาตุ
ตารางธาตุ (Periodictable) คือ ตารางที่ใช้แสดงรายชื่อธาตุเคมีคิดค้นขึ้นโดยนักเคมีชาวรัสเซีย ดมีตรี เมนเดเลเยฟ (Dmitri Mendeleev) ในปี พ.ศ. 2412 จากการสังเกตว่าเมื่อนำธาตุที่รู้จักมาวางเรียงตามลำดับเลขอะตอมจะพบว่า คุณสมบัติพื้นฐานบางอย่างคล้ายกัน สามารถจำแนกเป็นกลุ่มๆ ได้ทำให้เกิดรูปแบบตารางธาตุ และพัฒนาต่อเนื่องมาจนเป็นอย่างที่เห็น ตารางธาตุเป็นส่วนหนึ่งในการเรียนการสอนวิชาเคมีด้วย
ประวัติศาสตร์ของตารางธาตุ
เริ่มต้นจาก จอห์น นิวแลนด์สได้พยายามเรียงธาตุตามมวลอะตอมแต่เขากลับทำให้ธาตุที่มีสมบัติ ต่างกันมาอยู่ในหมู่เดียวกันนักเคมีส่วนมากจึงไม่ยอมรับตารางธาตุของนิ วแลนด์ส ต่อมา ดมีตรี เมนเดเลเยฟ จึงได้พัฒนาโดยพยายามเรียงให้ธาตุที่มีสมบัติเหมือนกันอยู่ในหมู่เดียว กันและเว้นช่องว่างไว้สำหรับธาตุที่ยังไม่ค้นพบพร้อมกันนั้นเขายังได้ ทำนายสมบัติของธาตุใหม่ไว้ด้วย โดยใช้คำว่า เอคา (Eka) นำหน้าชื่อธาตุที่อยู่ด้านบนของธาตุที่ยังว่างอยู่นั้น เช่น เอคา-อะลูมิเนียม(ต่อมาคือธาตุแกลเลียม) เอคา-ซิลิคอน (ต่อมาคือธาตุเจอร์เมเนียม)แต่นักเคมีบางคนในยุคนั้นยังไม่แน่ใจเนื่อง จากว่าเขาได้สลับที่ธาตุบางธาตุโดยเอาธาตุที่มีมวลอะตอมมากกว่ามาไว้หน้า ธาตุที่มีมวลอะตอมน้อยกว่าดมีตรีได้อธิบายว่า เขาต้องการให้ธาตุที่มีสมบัติเดียวกันอยู่ในหมู่เดียวกันเมื่อดมีตรีสามารถ ทำนายสมบัติของธาตุได้อย่างแม่นยำและตารางธาตุของเขาไม่มีข้อน่า สงสัยตารางธาตุของดมีตรีก็ได้รับความนิยมจากนักเคมีในสมัยนั้นจนถึงยุค ปัจจุบัน
ชื่อธาตุแบ่งตามหมู่
- หมู่ 1A ลิเทียม (Lithium) โซเดียม (Sodium -Natrium) โพแทสเซียม (Potassium – Kalium) รูบิเดียม (Rubidium) ซีเซียม (Cesium) แฟรนเซียม(Francium)
- หมู่ 2Aเบริลเลียม (Beryllium) แมกนีเซียม (Magnesium)แคลเซียม (Calcium) สตรอนเชียม (Strontium) แบเรียม (Barium) เรเดียม (Radium)
- หมู่ 3A โบรอน (Boron) อะลูมิเนียม (Aluminum) แกลเลียม (Gallium) อินเดียม (Indium) แทลเลียม (Thallium)
- หมู่ 4A คาร์บอน (Carbon) ซิลิกอน (Silicon) เจอร์เมเนียม (Germanium) ดีบุก (Tin -Stannum) ตะกั่ว (Lead – Plumbum)
- หมู่ 5A ไนโตรเจน (Nitrogen) ฟอสฟอรัส (Phosphorous) อะซินิค (สารหนู) (Arsenic) พลวง (Antimony -Stibium) บิสมัท (Bismuth)
- หมู่ 6A ออกซิเจน (Oxygen) ซัลเฟอร์ (กำมะถัน) (Sulfur)ซีลีเนียม (Selenium) เทลลูเรียม (Tellurium) พอโลเนียม (Polonium)
- หมู่ 7A ฟลูออรีน (Fluorine) คลอรีน (Chlorine) โบรมีน (Bromine) ไอโอดีน (Iodine) แอสทาทีน (Astatine)
- หมู่ 8A ฮีเลียม (Helium) นีออน (Neon) อาร์กอน (Argon) คริปตอน (Krypton) ซีนอน (Xenon) เรดอน (Radon)
ยกเว้นไฮโดรเจน เพราะยังถกเถียงกันอยู่ว่าจะจัดลงไปที่หมู่ 1 หรือ 7 ดี เพราะคุณสมบัติเป็นกึ่ง ๆ กัน ระหว่าง 1A กับ 7A และธาตุประเภททรานซิชัน
แหล่งกำเนิดของธาตุในจักรวาล
1. ไฮโดรเจนและฮีเลียมเกิดเริ่มแรกในจักรวาลหลังบิกแบง
2. ธาตุตัวที่ 3 คือลิเทียม ถึงตัวที่ 26 คือเหล็กเกิดจากภาวะอัดแน่นในดวงดาว
3. ธาตุตัวที่หนักกว่าเหล็กจนถึงยูเรเนียมเกิดจากดาวระเบิดหรือปรากฏการณ์ นิวเคลียร์ฟิวชั่นในดาวฤกษ์ (กรณีหลัง จะได้กัมมันตภาพรังสีเป็นส่วนมาก)
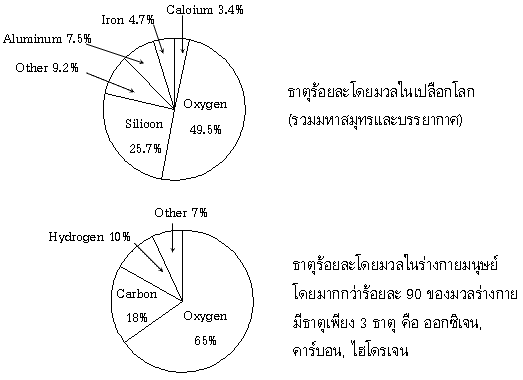
สารประกอบ (Compound) เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน ด้วยแรงยึดเหนี่ยวทางเคมี เกิดเป็นสารชนิดใหม่ เรียกว่าสารประกอบ
ดังนั้นหน่วยย่อยของสารประกอบคือ โมเลกุล ซึ่งอาจแยกสลายได้เมื่อได้รับความร้อนหรือพลังงานไฟฟ้า สารประกอบที่พบในชีวิตประจำวัน เช่น น้ำ (H2O) เกลือแกง (NaCl) น้ำตาลทราย (C12H22O11) น้ำตาลกลูโคส (C6H12O6) เอทานอล (C2H5OH) คาร์บอนไดออกไซด์ (CO2) หินปูน (CaCO3) ด่างทับทิม (KMnO4) เป็นต้น
RETURN TO CONTENTS
ประเภทและสมบัติของธาตุ
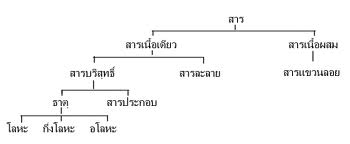
ธาตุและสาร ประกอบจัดเป็นสารเนื้อเดียว ซึ่งหมายถึงสารที่ประกอบด้วยธาตุเพียงชนิดเดียว สองชนิด หรือมากกว่าสองชนิดขึ้นไปผสมกันอย่างกลมกลืน จนมองเห็นเป็นเนื้อเดียวกันตลอด
ธาตุ คือ สารชนิดเดียวที่ไม่สามารถแยกหรือสลายออกไปเป็นสารอื่นได้ แบ่งออกเป็น2กลุ่ม ตามแหล่งที่มา ได้แก่ ธาตุที่เกิดขึ้นเองในธรรมชาติมีอยู่92ธาตุ และธาตุที่นักวิทยาศาสตร์สังเคราะห์ขึ้นในห้องทดลองอีกหลายธาตุ แต่เมื่อแบ่งธาตุตามสถานะสามารถแบ่งออกเป็น3ชนิด คือ
ธาตุ คือ สารชนิดเดียวที่ไม่สามารถแยกหรือสลายออกไปเป็นสารอื่นได้ แบ่งออกเป็น2กลุ่ม ตามแหล่งที่มา ได้แก่ ธาตุที่เกิดขึ้นเองในธรรมชาติมีอยู่92ธาตุ และธาตุที่นักวิทยาศาสตร์สังเคราะห์ขึ้นในห้องทดลองอีกหลายธาตุ แต่เมื่อแบ่งธาตุตามสถานะสามารถแบ่งออกเป็น3ชนิด คือ
1. โลหะโลหะมีสถานะเป็นของแข็งที่อุณหภูมิปกติ ยกเว้นปรอทชนิดเดียวที่มีสถานะเป็นของเหลว
2. อโลหะอโลหะเป็นธาตุที่เป็นได้ทั้ง 3 สถานะ คือ ของแข็ง ของเหลว และแก๊ส ดังแสดงในตารางธาตุ ธาตุอโลหะจะมีสมบัติตรงข้ามกับโลหะคือ เปราะ มีจุดเดือดต่ำและไม่นำไฟฟ้า มีทั้งหมด 21 ธาตุ ในจำนวน 21 ธาตุนี้มีเพียง 9 ธาตุที่มีสถานะเป็นของแข็งที่อุณหภูมิปกติ ส่วนที่เหลืออีก 12 ธาตุมีสถานะเป็นแก๊ส
3. กึ่งโลหะธาตุกึ่งโลหะ (semimetals) หรือ ธาตุเมทัลลอยด์ ( matalliods)หมายถึง ธาตุที่มีสมบัติกึ่งโลหะและอโลหะ เช่น ธาตุซิลิคอน มีลักษณะคล้ายของแข็งมีสีเงินวาว แต่เปราะง่ายคล้ายธาตุอโลหะ มีจุดเดือดสูงถึง 3,265 องศาเซลเซียส และนำไฟฟ้าได้เล็กน้อยธาตุกึ่งโลหะส่วนใหญ่จะเป็นสารกึ่งตัวนำ ( semiconductors ) และส่วนใหญ่มีโครงสร้างแบบโครงผลึกร่างตาข่ายจะอยู่ค่อนไปทางขวาของตารางธาตุจะเป็นเส้นทึบเป็นขั้นบันไดปรากฏอยู่
ใน ภาวะปกติ ธาตุบางชนิดดำรงอยู่สถานะของแข็ง บางชนิดเป็นของเหลว และบางชนิดเป็นแก๊ส เราแบ่งธาตุทั้งหมดออกได้เป็นสามพวกใหญ่ ๆ คือ โลหะ อโลหะ และกึ่งโลหะ ตัวอย่าง โลหะ และอโลหะที่เราพอรู้จักกันคือ
โลหะ
|
อโลหะ
|
ทองคำ (ของแข็ง)
เงิน (ของแข็ง)
เหล็ก (ของแข็ง)
ปรอท (ของแข็ง)
ตะกั่ว (ของแข็ง)
ดีบุก (ของแข็ง)
สังกะสี (ของแข็ง)
อลูมิเนียม (ของแข็ง)
โซเดียม (ของแข็ง)
แมกนีเซียม (ของแข็ง)
|
ไฮโดรเจน (แก๊ส)
ไนโตรเจน (แก๊ส)
ออกซิเจน (แก๊ส)
คลอรีน (แก๊ส)
โบรมีน (ของเหลว)
ไอโอดีน (ของแข็ง)
กำมะถัน (ของแข็ง)
อาร์กอน (แก๊ส)
คาร์บอน (ของแข็ง)
ฮีเลียม (แก๊ส)
|
ตำแหน่งของธาตุกึ่งโลหะเป็นดังนี้
ตารางแสดงสมบัติบางประการของธาตุกึ่งโลหะ
ธาตุ |
จำนวน เวเลนซ์อิเล็ก-
ตรอน |
รัศมี
อะตอม (pm) |
IE1
(KJ/mol) |
EN
(KJ/mol) |
ความ
หนาแน่น (g/cm3) |
จุด
หลอม- เหลว (C ) |
จุด
เดือด (C ) |
การนำ
ไฟฟ้า |
เกิดสาร
ประกอบ |
B
|
3
|
88
|
807
|
2.04
|
2.34
|
2075
|
4000
|
นำ
|
ไอออนิก
และ โคเเลนต์ |
Si
|
4
|
117
|
793
|
1.90
|
2.33
|
1414
|
3265
|
นำ
|
ไอออนิก
และ โครผลึก ร่างตข่าย |
Ge
|
4
|
122
|
768
|
2.01
|
5.32
|
938.25
|
2833
|
นำ
|
ไอออนิก
และ โคเเลนต์ |
As
|
5
|
121
|
951
|
2.18
|
5.75
|
358
ละลาย |
603
ระเหิด |
นำ
|
ไอออนิก
และ โคเเลนต์ |
Sb
|
5
|
141
|
840
|
2.05
|
6.68
|
630.64
|
1587
|
นำ
|
ไอออนิก
และ โคเเลนต์ |
Te
|
6
|
137
|
876
|
2.10
|
6.24
|
449.51
|
988
|
นำ
|
ไอออนิก
และ โคเเลนต์ |
Po
| 6 |
150
|
818
|
2.00
|
9.20
|
254
|
962
|
-
|
-
|
At
|
7
|
140
|
-
|
2.20
|
-
|
302
|
3200?
300 |
-
|
-
|
จาก ตาราง จะพบว่าธาตุกึ่งโลหะส่วนใหญ่มีค่าพลังงานไอออไนเซชันลำดับที่ 1 และค่าอิเล็กโทรเนกาติวิตีข้อนข้างสูง มีจุดเดือด จุดหลอมเหลว และความหนาแน่นมีค่าสูง และสามารถนำไฟฟ้าได้เช่นเดียวกับธาตุโลหะ สามารถเกิดสารประกอบไอออนิก และ สารประกอบโคเวเลนต์
จากสมบัติข้างต้นทำให้ได้ข้อมูลว่าตั้งแต่ธาตุโบรอนถึงธาตุแอสทาทีน โดยที่ตำแหน่งธาตุเหล่านี้อยู่ชิดเส้นทึบลักษณะขั้นบันไดในตารางธาตุตั้งแต่ หมู่ 3A ลงมามีสมบัติเป็นทั้งโลหะ และอโลหะจึงจัดเป็นธาตุกึ่งโลหะ
(ยกเว้นธาตุ Al มีสมบัติเป็นโลหะ และ Po และAt เป็นธาตุกัมมันตรังสี )
จากสมบัติข้างต้นทำให้ได้ข้อมูลว่าตั้งแต่ธาตุโบรอนถึงธาตุแอสทาทีน โดยที่ตำแหน่งธาตุเหล่านี้อยู่ชิดเส้นทึบลักษณะขั้นบันไดในตารางธาตุตั้งแต่ หมู่ 3A ลงมามีสมบัติเป็นทั้งโลหะ และอโลหะจึงจัดเป็นธาตุกึ่งโลหะ
(ยกเว้นธาตุ Al มีสมบัติเป็นโลหะ และ Po และAt เป็นธาตุกัมมันตรังสี )
แผนผังการจัดธาตุ 20 ธาตุแรกออกเป็นหมวดหมู่
เปรียบเทียบสมบัติของโลหะและอโลหะ
สมบัติของโลหะ
|
สมบัติของอโลหะ
|
| 1.มีสถานะเป็นของแข็งที่อุณหภูมิห้อง ยกเว้น ปรอทซึ่งเป็นของเหลว | 1.ที่อุณหภูมิห้องมีได้ทุกสถานะทั้งของแข็ง ของเหลวและก๊าซ |
| 2.เมื่อขัดจะมีความเป็นมันวาว | 2. เมื่อขัดจะไม่มีความมันวาว |
| 3.นำไฟฟ้าและนำความร้อนได้ดี แต่การนำไฟฟ้าจะลดลงเมื่ออุณหภูมิสูงขึ้น | 3. ไม่นำไฟฟ้าและความร้อน ยกเว้นบางตัว เช่นแกร์ไฟต์นำไฟฟ้าได้ |
| 4.เคาะจะมีเสียงกังวาน | 4. เคาะจะไม่มีเสียงกังวาน |
| 5.แข็งและเหนียวสามารถตีแผ่ให้เป็นแผ่นหรือดึงเป็นเส้นได้ | 5.ส่วนมากเปราะไม่สามารถจะทำให้เป็นแผ่นหรือเป็นเส้นได้ |
| 6. มีจุดหลอมเหลวและจุดเดือดสูง | 6. ส่วนมากมีจุดหลอมเหลวและจุดเดือดต่ำ |
| 7.มีความหนาแน่นและความถ่วงจำเพาะสูง | 7. ส่วนมากมีความหนาแน่นและความถ่วงจำเพาะต่ำ |
| 8.เป็นพวกชอบให้อิเล็กตรอน ทำให้เกิดเป็นไอออนบวก | 8. เป็นพวกชอบรับอิเล็กตรอน ทำให้เกิดเป็นไอออนลบ |
| 9.เกิดเป็นสารประกอบเช่น ออกไซด์ คลอไรด์ ซัลไฟด์ และไฮไดร์ได้ | 9. เกิดเป็นสารประกอบ เช่น ออกไซด์ คลอไรด์ ซัลไฟด์ และไฮไดร์ได้ |
| 10.ส่วนใหญ่จำทำปฏิกิริยากับกรดเจือจางให้ก๊าซไฮโดรเจน | 10 ไม่ทำปฏิกิริยากับกรดเจือจาง |
โลหะมี สมบัติบางอย่างคล้ายกับสารประกอบไอออนิก เช่นเป็นของแข็ง มีจุดหลอมเหลวสูง และมีสมบัติเฉพาะตัวของโลหะเช่น นำไฟฟ้า นำความร้อน รีดเป็นแผ่น ดึงเป็นเส้น รวมทั้งสะท้อนแสงได้ อย่างไรก็ตามเมื่อเปรียบเทียบการนำไฟฟ้าของโลหะกับสารไอออนิกจะพบว่าต่างกัน มาก สารไอออนิกที่หลอมเหลวจะมีการนำไฟฟ้าได้น้อยกว่าโลหะมาก แม้ว่าจะมีอุณหภูมิสูง
การที่โลหะเป็นพวกชอบให้อิเล็กตรอน เพราะมีพลังงานไอออไนเซชันต่ำ แต่พวกอโลหะมีพลังงานไอออไนเซชัน และอิเล็กโตรเนกาติวิตีสูง จึงเป็นพวกชอบรับอิเล็กตรอน
การที่โลหะนำความร้อนและไฟฟ้าได้ดี เพราะมีพันธะโลหะซึ่งเวเลนซ์อิเล็กตรอนของโลหะสามารถเคลื่อนที่นำไฟฟ้าได้
การที่ทำโลหะให้เป็นแผ่นได้เพราะการ ตีโลหะแผ่ออกเป็นการผลักอนุภาคของโลหะให้เลื่อนไถลผ่านกันโดยไม่หลุดออกจาก กันเนื่องจากมีพันธะหรือมีเวเลนซ์อิเล็กตรอนยึดอนุภาคเหล่านี้ไว้ด้วยกัน
นอกจาก สมบัติเกี่ยวกับความเป็นโลหะแล้ว ยังได้ศึกษาสมบัตอื่น ๆ อีกบางประการเพื่อใช้ประกอบการจัดธาตุออกเป็นหมวดหมู่ สถานะ สี ความว่องไวในการเกิดปฏิกิริยา จุดหลอมเหลวและความหนาแน่น เป็นต้น ดังในตารางที่ 5.2
ตารางที่ 5.2 สมบัติบางประการของ 20 ธาตุแรก เรียงตามมวลอะตอม
ธาตุ
|
สัญลักษณ์
|
มวลอะตอม
|
ลักษณะที่อุณหภูมิปกติ
|
mp.(0C)
|
d (g/cm3)
|
ความเป็นโลหะ-อโลหะ
|
ความว่องไวในการเกิดปฏิกิริยา
|
ไฮโดรเจน
|
H
|
1.008
|
ก๊าซไม่มีสี
|
-259
|
0.07*
|
อโลหะ
|
มาก
|
ฮีเลียม
|
He
|
4.003
|
ก๊าซไม่มีสี
|
-272
|
0.15*
|
โลหะ
|
ไม่เกิด
|
ลิเทียม
|
Li
|
6.94
|
ของแข็งสีเงิน
|
180
|
0.53
|
โลหะ
|
มาก
|
เบริลเลียม
|
Be
|
9.01
|
ของแข็งสีเงิน
|
1280
|
1.45
|
โลหะ
|
ปานกลาง
|
โบรอน
|
B
|
10.81
|
ของแข็งสีดำ
|
2030
|
2.34
|
กึ่งโลหะ
|
ปานกลาง
|
คาร์บอน
|
C
|
12.01
|
ของแข็งสีดำ
|
3730
|
2.26
|
อโลหะ
|
น้อย
|
ไนโตรเจน
|
N
|
14.01
|
ก๊าซไม่มีสี
|
-210
|
0.81*
|
อโลหะ
|
ปานกลาง
|
ออกซิเจน
|
O
|
16.00
|
ก๊าซไม่มีสี
|
-219
|
1.15*
|
อโลหะ
|
มาก
|
ฟลูออรีน
|
F
|
19.00
|
ก๊าซสีเหลืองอ่อน
|
-220
|
1.51*
|
อโลหะ
|
มาก
|
นีออน
|
Ne
|
20.18
|
ก๊าซไม่มีสี
|
-249
|
1.20*
|
อโลหะ
|
ไม่เกิด
|
โซเดียม
|
Na
|
22.99
|
ของแข็งสีเงิน
|
98
|
0.97
|
โลหะ
|
มาก
|
แมกนีเซียม
|
Mg
|
24.31
|
ของแข็งสีเงิน
|
650
|
1.74
|
โลหะ
|
มาก
|
อะลูมิเนียม
|
Al
|
26.98
|
ของแข็งสีเงิน
|
660
|
2.70
|
โลหะ
|
ปานกลาง
|
ซิลิคอน
|
Si
|
28.09
|
ของแข็งสีเทา
|
1410
|
2.33
|
กึ่งโลหะ
|
ปานกลาง
|
ฟอสฟอรัส
|
P
|
30.97
|
ของแข็งสีขาว
|
44
|
1.82
|
อโลหะ
|
มาก
|
กำมะถัน
|
S
|
32.06
|
ของแข็งสีเหลือง
|
113
|
1.96
|
อโลหะ
|
ปานกลาง
|
คลอรีน
|
Cl
|
35.45
|
ก๊าซสีเขียวอ่อน
|
-101
|
1.56*
|
อโลหะ
|
มาก
|
โพแทสเซียม
|
K
|
39.10
|
ของแข็งสีเงิน
|
64
|
0.86
|
โลหะ
|
มาก
|
อาร์กอน
|
Ar
|
39.95
|
ก๊าซไม่มีสี
|
-189
|
1.40
|
อโลหะ
|
ไม่เกิด
|
แคลเซียม
|
Ca
|
40.08
|
ของแข็งสีขาว
|
838
|
1.55
|
โลหะ
|
มาก
|
mp. = จุดหลอมเหลว d = ความหนาแน่น * = ความหนาแน่นขณะเป็นของเหลว
นอกจากนี้ยังได้พิจารณาสมบัติเกี่ยวกับความมันวาว การนำความร้อน การนำไฟฟ้า และความเหนียวของธาตุบางชนิด ดังในตารางที่ 5.3
ตารางที่ 5.3 สมบัติอื่น ๆ บางประการของธาตุบางชนิด
ธาตุ
|
ความมันวาว
|
การนำความร้อน
|
การนำไฟฟ้า
|
ความเหนียว
|
Al
|
เป็นมันวาว
|
นำได้ดี
|
นำได้ดี
|
เหนียว
|
Mg
|
เป็นมันวาว
|
นำได้ดี
|
นำได้ดี
|
เหนียว
|
C(แกรไฟต์)
|
ไม่มันวาว
|
นำได้ดี
|
นำได้ดี
|
เปราะ
|
S
|
ไม่มันวาว
|
ไม่นำ
|
ไม่นำ
|
เปราะ
|
P
|
ไม่มันวาว
|
ไม่นำ
|
ไม่นำ
|
เปราะ
|
จะเห็น ได้ว่า ธาตุที่เป็นโลหะจะมีสมบัติของโลหะทั้งหมดดังที่กล่าวมาแล้ว แต่มีธาตุหลายชนิดที่มีสมบัติทั้งของโลหะและอโลหะผสมกัน คือสมบัติบางประการเป็นโลหะและสมบัติบางประการเป็นอโลหะ มีธาตุไม่กี่ชนิดเท่านั้นที่มีสมบัติของโลหะ หรืออโลหะอย่างใดอย่างหนึ่งครบถ้วนทุกประการ อย่างไรก็ตามถึงแม้ว่าธาตุต่าง ๆ จะมีทั้งสมบัติของโลหะและอโลหะผสมกัน ธาตุใดที่มีสมบัติส่วนใหญ่ของโลหะจะจัดว่าเป็นโลหะ และธาตุที่มีสมบัติส่วนใหญ่ของอโลหะจะจัดว่าเป็นอโลหะ ในกรณีที่ธาตุนั้นมีสมบัติของโลหะและอโลหะก้ำกึ่งกัน จนไม่สามารถจำแนกได้ว่าเป็นโลหะหรืออโลหะ ธาตุประเภทนั้นจะจัดไว้เป็นอีกกลุ่มหนึ่งต่างหากเรียกว่าธาตุกึ่งโลหะ ดังเช่น ในตารางที่ 5.2
หมายเหตุ ธาตุกึ่งโลหะยังอาจจะจัดได้เป็น 2 พวก ตามเกณฑ์ที่กำหนดที่แตกต่างกัน คือใช้การนำไฟฟ้าและใช้สมบัติของออกไซด์
RETURN TO CONTENTS
สมบัติและประเภทของสารประกอบ
สารประกอบเป็นสารเคมีที่เกิดจากธาตุเคมีตั้งแต่สองตัวขึ้นไปมารวมตัวกันโดย พันธะเคมีด้วยอัตราส่วนของส่วนประกอบที่แน่นอน ตัวอย่าง เช่น ไดไฮโรเจนโมน็อกไซด์ หรือ น้ำ มีสูตรเคมีคือ H2Oซึ่งเป็นสารที่ประกอบด้วย ไฮโดรเจน 2 อะตอม และ ออกซิเจน 1 อะตอม
ในสารประกอบอัตราส่วนของส่วนประกอบจะต้องคงที่และตัวชี้วัดความเป็นสารประกอบที่สำคัญคือ คุณสมบัติทางกายภาพ ซึ่งจะแตกต่างจาก ของผสม(mixture) หรือ อัลลอย (alloy) เช่น ทองเหลือง(brass) ซูเปอร์คอนดักเตอร์ YBCO, สารกึ่งตัวนำ อะลูมิเนียม แกลเลียม อาร์เซไนด์ (aluminium gallium arsenide) หรือ ซ็อกโกแลต (chocolate) เพราะเราสามารถกำหนดอัตราส่วนของ ของผสมได้
ตัวกำหนดคุณลักษณะเฉพาะของสารประกอบที่สำคัญคือ สูตรเคมี (chemical formula) ซึ่งจะแสดงอัตราส่วนของอะตอมในสารประกอบนั้นๆ และจำนวนอะตอมในโมเลกุลเดียว เช่น สูตรเคมีของ อีทีน (ethene) จะเป็นC2H4ไม่ใช่ CH2) สูตรไม่ได้ระบุว่าสารประกอบประกอบด้วยโมเลกุล เช่น โซเดียมคลอไรด์ (เกลือแกง, NaCl) เป็น สารประกอบไอออนิก (ionic compound)
ประเภทของสารประกอบ
- กรด
- เบส
- สารประกอบไอออนิก (ionic compound)
- ออกไซด์
- สารประกอบอินทรีย์
1. กรด (อังกฤษ: acid, มาจากภาษาละติน acidus/acēre หมายถึง "เปรี้ยว") เป็นสสารซึ่งทำปฏิกิริยากับเบส โดยทั่วไป กรดสามารถระบุได้ด้วยรสเปรี้ยว, สมบัติทำปฏิกิริยากับโลหะอย่างแคลเซียม และเบสอย่างโซเดียมคาร์บอเนต กรดที่ละลายน้ำมี pH น้อยกว่า 7 โดยที่กรดจะแรงขึ้นตามค่า pH ที่ลดลง และเปลี่ยนกระดาษลิตมัสสีน้ำเงินเป็นแดง
ตัวอย่างทั่วไปของกรด รวมไปถึง กรดน้ำส้ม (น้ำส้มสายชู), กรดซัลฟิวริก (ในแบตเตอรีรถยนต์), และกรดทาร์ทาริก (ในการทำขนม) ดังสามตัวอย่างข้างต้น กรดสามารถเป็นได้ทั้งสารละลาย ของเหลวหรือของแข็ง สำหรับแก๊ส อย่างเช่น ไฮโดรเจนคลอไรด์ ก็เป็นกรดได้เช่นกัน กรดแรงและกรดอ่อนเข้มข้นบางตัวมีฤทธิ์กัดกร่อน แต่มีข้อยกเว้น เช่น คาร์บอรีนและกรดบอริก
นิยามกรดโดยทั่วไปมีสามนิยาม ได้แก่ นิยามอาร์เรเนียส นิยามเบรินสเตด-ลาวรี และนิยามลิวอิส นิยามอาร์เรเนียสกล่าววว่า กรดคือ สสารที่เพิ่มความเข้มข้นของไฮโดรเนียมไอออน (H3O+) ในสารละลาย นิยามเบรินสเตด-ลาวรีเป็นการขยายขึ้น คือ กรดเป็นสสารซึ่งสามารถทำหน้าที่ให้โปรตอน กรดส่วนมากที่พบในชีวิตประจำวันเป็นสารละลายในน้ำ หรือสามารถละลายได้ในน้ำ และสองนิยามนี้เกี่ยวเนื่องที่สุด สาเหตุที่ pH ของกรดน้อยกว่า 7 นั้น เป็นเพราะความเข้มข้นของไฮโดรเนียมไอออนมากกว่า 10-7โมลต่อลิตร เนื่องจาก pH นิยามเป็นลอการิทึมลบ ของความเข้มข้นของไฮโดรเนียมไออน ดังนั้น กรดจึงมี pH น้อยกว่า 7 ตามนิยามเบรินสเตด-ลาวรี สารประกอบใดซึ่งสามารถให้โปรตอนง่ายสามารถพิจารณาได้ว่าเป็นกรด ตัวอย่างมีแอลกอฮอล์และเอมีน ซึ่งมีหมู่ O-H หรือ N-H
ในทางเคมี นิยามกรดลิวอิสเป็นนิยามที่พบมากที่สุด กรดลิวอิสเป็นตัวรับอิเล็กตรอนคู่โดดเดี่ยว ตัวอย่างกรดลิวอิส รวมไปถึงไอออนลบโลหะทั้งหมด และโมเลกุลอิเล็กตรอนน้อย เช่น โบรอนฟลูออไรด์ และอะลูมิเนียมไตรคลอไรด์ ไฮโดรเนียมไอออนเป็นกรดตามทั้งสามนิยามข้างต้น ที่น่าสนใจคือ แม้แอลกอฮอล์และเอมีนสามารถเป็นกรดเบรินเสตด-ลาวรีได้ตามที่อธิบายข้างต้น ทั้งสองยังทำหน้าที่เป็นเบสลิวอิสได้ เนื่องจากอะตอมออกซิเจนและไนโตรเจนมีอิเล็กตรอนคู่โดดเดี่ยว
2. เบสตามคำจำกัดความของอาร์รีเนียส (Svante Arrhenius) คือ สารประกอบเคมีที่ดูดไฮโดรเนียมไอออน เมื่อละลายในน้ำ (ผู้รับโปรตอน) เบสที่ละลายในน้ำเรียกว่าอัลคาไลในที่ที่สิ่งแวดล้อมเป็นน้ำ ไฮดรอกไซด์ไอออนจะถูกให้ เบสและกรดถูกมองว่าอยูตรงข้ามกันเพราะว่าผลของกรดคือการเพิ่มความเข้มข้นของไฮโดรเนียมไอออน (H3O+) ในน้ำ, ในขณะที่เบสลดความเข้มข้น เบส อาร์รีเนียสเมื่อละลายน้ำสารละลายของมันจะมี pH มากกว่า 7 เสมอ กรดเมื่อผสมกับเบสจะสะเทิน
3. สารประกอบไอออนิก(อังกฤษ:Ionic compound) เป็นสารประกอบเคมีที่เกิดจากโลหะ (ที่มีประจุบวก) กับอโลหะ (ที่มีประจุลบ) มารวมกันเป็นสารประกอบ (หรือเรียกว่าเป็นเกลือ) โดยยึดเหนี่ยวกันด้วยพันธะไอออนิก ซึ่งสารประกอบไอออนิกจะเป็นสารประกอบที่ไม่มีสูตรเคมี แต่สามารถเขียนสูตรอย่างง่ายได้ เพราะไอออนจะเกาะกันหลายตัว ส่วนใหญ่จะเป็น เกลือกับเบส
4. ออกไซด์หมายถึง สารประกอบ ที่เกิดจาก ธาตุออกซิเจน รวมกับธาตุอื่นๆ
- - ออกไซด์ของโลหะออกไซด์ของโลหะส่วนใหญ่เป็น สารประกอบไอออนิก และเป็นเบส เช่น แคลเซียมไฮดรอกไซด์ ( CaO ) ฯลฯ ออกไซด์ของโลหะทรานซิชั่น อาจเรียกว่า สนิม
- - ออกไซด์ของกึ่งโลหะรวมถึง ออกไซด์ของโลหะบางชนิด เป็นได้ทั้งกรดและเบส เช่น อะลูมิเนียมออกไซด์ ( Al2O3) ฯลฯ
- - ออกไซด์ของอโลหะเป็นสารประกอบโควาเลนต์ และเกือบทั้งหมดเป็นกรด เช่น คาร์บอนไดออกไซด์ ( CO2)
5.สารประกอบอินทรีย์หมายถึง สารประกอบเคมีที่อยู่ในสถานะใดก็ได้ ไม่ว่าจะเป็นของแข็ง ของเหลว หรือแก๊ส ที่ประกอบด้วยโมเลกุลคาร์บอน ยกเว้นสารประกอบบางชนิดที่ไม่จัดว่าเป็นสารประกอบอินทรีย์แม้ว่าจะมีคาร์บอนเป็นองค์ประกอบก็ตาม ตัวอย่างเช่น สารประกอบคาร์ไบน์, คาร์บอเนต, ออกไซด์ของคาร์บอนและไซยาไนด์ เช่นเดียวกับอัญรูปของคาร์บอน อย่างเช่น เพชรและแกรไฟต์ ซึ่งถูกจัดเป็นสารประกอบอนินทรีย์ ความแตกต่างระหว่างสารประกอบคาร์บอนที่เป็นสารประกอบ "อินทรีย์" และ "อนินทรีย์" นั้น ถึงแม้ว่า "จะมีประโยชน์ในการจัดระเบียบวิชาเคมีอย่างกว้างขวาง... แต่ก็ค่อนข้างไร้เหตุผลอยู่เหมือนกัน"
ประเภทสารประกอบจำแนกตามพันธะภายในสารประกอบ
- พันธะโคเวเลนต์ (Covalent Bond)เป็นพันธะที่มีการใช้อิเล็กตรอนวงนอกสุดร่วมกันเพื่อให้ครบตามกฎออกเตต (Octet's Rule) คือมีอิเล็กตรอนวงนอกสุดครบ 8 ตัว ซึ่งยังมีพันธะโคเวเลนต์อีกชนิดหนึ่งคือ พันธะโคออร์ดิเนตโคเวเลนต์ (Coordinate Covalent Bond) ซึ่งเกิดจากการที่อะตอมหนึ่งให้อิเล็กตรอนทั้ง 2 ตัวแก่อิเล็กตรอนอีกตัวหนึ่งใช้ร่วมกัน สารประกอบเหล่านี้เรียกว่า สารประกอบโคเวเลนต์ (Covalent Compound)
- พันธะไอออนิก (Ionid Bond)เป็นพันธะที่เกิดจากการเสียและรับอิเล็กตรอนของอะตอมและเกิดแรงทางไฟฟ้าซึ่งกันและกันระหว่างไอออนบวกและไอออนลบ เกิดเป็นโครงผลึกขนาดยักษ์ ไม่มีโมเลกุล ซึ่งไอออนบวกและไอออนลบนี้จะเป็นอะตอมหรือกลุ่มอะตอมก็ได้ สารประกอบเหล่านี้เรียกว่า สารประกอบไอออนิก (Ionic Compound)
- พันธะโครงผลึกร่างตาข่ายเป็นพันธะที่แข็งแรงที่สุด และเป็นพันธะที่ไม่มีโมเลกุล พบในสารประเภท ทราย คาร์โบรันดัม เพชร แกรไฟต์ เป็นต้น
นอกจากนี้สารประกอบอาจจำแนกตามแหล่งกำเนิดได้ดังนี้
1. สารประกอบธรรมชาติ
สารประกอบธรรมชาติ หมายความถึง สารประกอบที่ผลิตขึ้นจากพืชหรือสัตว์ สารประกอบจำนวนมากยังคงถูกสกัดจากแหล่งธรรมชาติ เนื่องจากสารประกอบเหล่านี้จะแพงกว่ามากหากผลิตขึ้นโดยมนุษย์ ตัวอย่างเช่น น้ำตาลส่วนใหญ่ อัลคาลอยด์และเทอร์ปินอยด์บางชนิด สารอาหารบางชนิด เช่น วิตามินบี12 และโดยทั่วไปแล้วผลิตภัณฑ์จากธรรมชาติเหล่านี้ที่มีโมเลกุลซับซ้อนขนาดใหญ่มักจะพบในความเข้มข้นพอสมควรในสิ่งมีชวิต
สารประกอบอื่นที่มีความสำคัญอย่างยิ่งในชีวโมเลกุล คือ แอนติเจน, คาร์โบไฮเดรต, เอ็นไซม์, ฮอร์โมน, ลิพิตและกรดไขมัน, สารสื่อประสาท, กรดนิวคลีอิก, โปรตีน, เพปไทด์และกรดอะมิโน, เลกติน, วิตามินและไขมันและน้ำมัน
2. สารประกอบสังเคราะห์
สารประกอบที่ถูกจัดเตรียมขึ้นโดยปฏิกิริยากับสารประกอบอื่นจะถูกเรียกว่า "สารประกอบสังเคราะห์" สารประกอบเหล่านี้อาจเป็นสารประกอบที่พบอยู่แล้วในพืชหรือสัตว์ (สารประกอบกึ่งสังเคราะห์) หรือสารที่ไม่พบตามธรรมชาติก็ได้ พอลิเมอร์ส่วนใหญ่ ซึ่งรวมไปถึงพลาสติกและยาง เป็นสารประกอบอินทรีย์สังเคราะห์หรือกึ่งสังเคราะห์
สมบัติของสารประกอบคลอไรด์และสารประกอบออกไซด์
การเกิดและสมบัติของสารประกอบคลอไรด์ ออกไซด์ของธาตุในคาบที่ 2 และคาบที่ 3 สรุปได้ดังนี้
1. เนื่องจากในคาบเดียวกันประกอบด้วยโลหะ( ทางซ้าย ) กึ่งโลหะ และอโลหะ( ทางขวา ) แต่ละธาตุมีเวเลนซ์อิเล็กตรอนไม่เท่ากัน ดังนั้นการเกิดสารประกอบของธาตุในคาบเดียวกันจึงต่างกันและสารประกอบที่ได้ ส่วนใหญ่มีสมบัติต่างกัน
2. อโลหะซึ่งอยู่ทางขวาทำปฏิกิริยากับธาตุชนิดหนึ่งเกิดสารประกอบได้หลายชนิด จึงทำให้มีเลขออกซิเดชันได้หลายค่า ส่วนธาตุโลหะซึ่งอยู่ทางซ้าย เมื่อทำปฏิกิริยากับอโลหะชนิดหนึ่งมักเกิดสารประกอบได้ชนิดเดียว จึงทำให้มีเลขออกซิเดชันได้เพียงค่าเดียว
3. สารประกอบคลอไรด์ และออกไซด์ ของโลหะเป็นสารประกอบไอออนิก ยกเว้นBeCl2เป็น สารประกอบโคเวเลนต์ จึงมีจุดหลอมเหลวและจุดเดือดสูง เพราะการหลอมเหลวและการเดือดต้องสลายพันธะไอออนิก ซึ่งเป็นพันธะที่แข็งแรง ส่วนสารประกอบคลอไรด์และออกไซด์ของอโลหะ เป็นสารประกอบโคเวเลนต์ จึงมีจุดหลอมเหลวและจุดเดือดต่ำ เพราะการหลอมเหลวและการเดือดทำลายเพียงแรงยึดเหนี่ยวระหว่างโมเลกุล ซึ่งอาจเป็นแรงแวนเดอร์วาลส์ชนิดแรงลอนดอน ( โมเลกุลไม่มีขั้ว ) หรือแรงแวนเดอร์วาลส์ชนิดแรงดึงดูดระหว่างขั้วบวกกับขั้วลบของโมเลกุล ( โมเลกุลมีขั้ว ) เนื่องจากแรงแวนเดอร์วาลส์เป็นแรงที่อ่อนจึงทำให้สารประกอบของอโลหะมีจุด หลอมเหลว จุดเดือดต่ำ ยกเว้นโมเลกุลที่มีมวลโมเลกุลมาก เช่นP2O5, P2S5, PCl5มีจุดหลอมเหลวค่อนข้างสูง สำหรับสารประกอบของธาตุกึ่งโลหะ คือBและSiบางชนิดมีจุดหลอมเหลวจุดเดือดค่อนข้างสูง ได้แก่B2O3, B2S3บางชนิดมีจุดหลอมเหลวจุดเดือดสูงมาก ได้แก่SiO2เพราะเป็นสารโครงผลึกร่างตาข่าย แต่บางชนิดมีจุดหลอมเหลวต่ำ ได้แก่BCl3, SiCl4
4. สารประกอบของธาตุที่เป็นโลหะที่ภาวะปกติมีสถานะเป็นของแข็ง ไม่นำไฟฟ้า แต่เมื่อหลอมเหลวนำไฟฟ้าได้ เพราะเป็นสารประกอบไอออนิก ส่วนสารประกอบของธาตุที่เป็นอโลหะส่วนใหญ่มีสถานะเป็นก๊าซหรือของเหลว เพราะเป็นสารประกอบโคเวเลนต์
5. สารละลายของสารประกอบออกไซด์ของโลหะ ส่วนใหญ่มีสมบัติเป็นเบส ( เบสิกออกไซด์ ) ส่วนสารประกอบออกไซด์ของอโลหะมีสมบัติเป็นกรด
6. สารประกอบของธาตุในคาบที่ 2 และคาบที่ 3 บางชนิดไม่ละลายน้ำ ได้แก่BeO , Al2O3, SiO2, BeS , CS2, P2S5, NCl3และCCl4
7. SiO2ไม่ละลายน้ำ แต่มีสมบัติเป็นกรด เพราะSiO2สามารถละลายในสารละลายเบสได้ ( ทำปฏิกิริยากับเบสได้ ) เช่น สารละลายNaOH *สารที่ทำปฏิกิริยากับสารละลายเบสได้คือกรด และสารที่ทำปฏิกิริยากับสารละลายกรดได้คือเบส
8.BeOและAl2O3ไม่ละลายน้ำแต่มีสมบัติเป็นได้ทั้งกรดและเบส เพราะBeOและAl2O3ละลายได้ทั้งสารสารละลายกรด เช่น สารละลายกรดไฮโดรคลอริก (HCl )และสารละลายเบส เช่น สารละลายโซเดียมไฮดรอกไซด์ (NaOH )( ทำปฏิกิริยากับสารละลายกรดและสารละลายเบสได้ )
เบส แสดงว่าBeOมีสมบัติเป็นกรดกรด แสดงว่าBeOมีสมบัติเป็นเบส
9. สารประกอบคลอไรด์ของโลหะมีสถานะเป็นของแข็ง มีจุดหลอมเหลว จุดเดือดสูง เพราะเป็นสารประกอบไอออนิก ส่วนสารประกอบคลอไรด์ของอโลหะ ส่วนใหญ่มีสถานะเป็นก๊าซหรือของเหลว มีจุดเดือด จุดหลอมเหลวต่ำ ส่วนคลอไรด์ของกึ่งโลหะ (BCl3และSiCl4)มีสถานะเป็นของเหลว มีจุดหลอมเหลว จุดเดือดต่ำ เพราะคลอไรด์ของอโลหะและของกึ่งโลหะเป็นสารประกอบโคเวเลนต์
10. สารประกอบคลอไรด์ของโลหะมีสมบัติเป็นกลางหรือกรด ( คลอไรด์ของหมู่IAและIIAเป็นกลาง ยกเว้นBeCl2ซึ่งเป็นสารประกอบโคเวเลนต์เป็นกรด และคลอไรด์ของโลหะหมู่IIIAเป็นกรด)ส่วนคลอไรด์ของอโลหะมีสมบัติเป็นกรด
11. แนวโน้มความเป็นกรดและความเป็นเบสของสารประกอบออกไซด์ในตารางธาตุ คือ ความเป็นกรดเพิ่มขึ้นจากซ้ายไปขวาภายในคาบเดียวกัน และความเป็นกรดลดลงจากบนลงล่างภายในหมู่เดียวกัน ส่วนความเป็นเบสลดลงจากซ้ายไปขวาภายในคาบเดียวกันและเพิ่มขึ้นจากบนลงล่าง ภายในหมู่เดียวกัน ( แนวโน้มความเป็นกรดของสารประกอบออกไซด์ เหมือนแนวโน้มของความเป็นอโลหะ ส่วนแนวโน้มความเป็นเบสของสารประกอบออกไซด์เหมือนแนวโน้มของความเป็นโลหะ )
ตารางแสดงสมบัติของสารประกอบคลอไรด์ของธาตุคาบที่ 2 และคาบที่ 3
ตารางแสดงสมบัติของสารประกอบออกไซด์ของธาตุคาบที่ 2 และคาบที่ 3
RETURN TO CONTENTS
ธาตุและสารประกอบที่ใช้ในชีวิตประจำวัน
ในชีวิตประจำวันเราจะต้องเกี่ยวข้องกับสารหลายชนิด ซึ่งมีลักษณะแตกต่างกัน สารที่ใช้ในชีวิตประจำวันจะมีสารเคมีเป็นองค์ประกอบ ซึ่งสามารถจำแนกเป็นสารสังเคราะห์และสารธรรมชาติ เช่น สารปรุงรสอาหาร สารแต่งสีอาหาร สารทำความสะอาด สารกำจัดแมลงและสารกำจัดศัตรูพืช เป็นต้น ในการจำแนกสารเคมีเป็นพวกๆ นั้นเราใช้วัตถุประสงค์ในการใช้เป็นเกณฑ์การจำแนก ดังรายละเอียดต่อไปนี้
1. สารปรุงแต่งอาหาร
1.1 ความหมายสารปรุงแต่งอาหาร
สาร ปรุงแต่งอาหาร หมายถึง สารปรุงรสอาหารใช้ใส่ในอาหารเพื่อทำให้อาหารมีรสดีขึ้น เช่น น้ำตาล น้ำปลา น้ำส้มสายชู น้ำมะนาว ซอสมะเขือเทศ และให้รสชาติต่างๆ เช่น
- น้ำตาล ให้รสหวาน
- เกลือ น้ำปลา ให้รสเค็ม
- น้ำส้มสายชู น้ำมะนาว ซอสมะเขือเทศ ให้รสเปรี้ยว
สาร ปรุงแต่งอาหาร หมายถึง สารปรุงรสอาหารใช้ใส่ในอาหารเพื่อทำให้อาหารมีรสดีขึ้น เช่น น้ำตาล น้ำปลา น้ำส้มสายชู น้ำมะนาว ซอสมะเขือเทศ และให้รสชาติต่างๆ เช่น
- น้ำตาล ให้รสหวาน
- เกลือ น้ำปลา ให้รสเค็ม
- น้ำส้มสายชู น้ำมะนาว ซอสมะเขือเทศ ให้รสเปรี้ยว
1.2 ประเภทของสารปรุงแต่งอาหาร แบ่งเป็น 2 ประเภท คือ
1) ได้จากการสังเคราะห์ เช่น น้ำส้มสายชู น้ำปลา ซีอิ๊ว ซอสมะเขือเทศ เป็นต้น
1) ได้จากการสังเคราะห์ เช่น น้ำส้มสายชู น้ำปลา ซีอิ๊ว ซอสมะเขือเทศ เป็นต้น
2) ได้จากธรรมชาติ เช่น เกลือ น้ำมะนาว น้ำมะขามเปียก อัญชัน เป็นต้น
2. เครื่องดื่ม
เครื่องดื่ม หมายถึง สิ่งที่มนุษย์จัดเตรียมสำหรับดื่ม และมักจะมี น้ำ เป็นส่วนประกอบหลัก บางประเภทได้คุณค่าทางโภชนาการ บางประเภทดื่มแล้วไปกระตุ้นระบบประสาท และบางประเภทดื่มเพื่อดับกระหาย แบ่งออกเป็น 7 ประเภท ได้แก่ น้ำดื่มสะอาด น้ำผลไม้ นม น้ำอัดลม เครื่องดื่มบำรุงกำลัง ชาและกาแฟ และเครื่องดื่มแอลกอฮอล์
1) น้ำดื่มสะอาด
น้ำ ดื่มสะอาด เป็นเครื่องดื่มที่ไม่สิ่งอื่นเจือปน เป็นประโยชน์ต่อกระบวนการต่างๆ ในร่างกาย ปัจจุบันน้ำดื่มสะอาดได้รับความนิยมมาก ผู้ผลิตมักจะบรรจุน้ำดื่มในขวดใสสะอาดแก้วที่สะอาด เหมาะสำหรับที่จะเสิร์ฟในร้านอาหาร หรือในงานเลี้ยงต่าง ๆ ได้เป็นอย่างดี ผู้ที่ควบคุมน้ำหนักส่วนใหญ่มักจะเลือกเครื่องดื่มชนิดนี้แทนเครื่องดื่มที่ มีรสหวานอื่นๆ
น้ำ ดื่มสะอาด เป็นเครื่องดื่มที่ไม่สิ่งอื่นเจือปน เป็นประโยชน์ต่อกระบวนการต่างๆ ในร่างกาย ปัจจุบันน้ำดื่มสะอาดได้รับความนิยมมาก ผู้ผลิตมักจะบรรจุน้ำดื่มในขวดใสสะอาดแก้วที่สะอาด เหมาะสำหรับที่จะเสิร์ฟในร้านอาหาร หรือในงานเลี้ยงต่าง ๆ ได้เป็นอย่างดี ผู้ที่ควบคุมน้ำหนักส่วนใหญ่มักจะเลือกเครื่องดื่มชนิดนี้แทนเครื่องดื่มที่ มีรสหวานอื่นๆ
2) น้ำผลไม้
น้ำผลไม้เป็น เครื่องดื่มที่มีประโยชน์มากอย่างหนึ่ง และต้องเป็นน้ำผลไม้ที่สดๆ จึงจะได้คุณค่ามาก ผู้ผลิตมักจะนำผลไม้ที่มีมากในฤดูกาลมาคั้นเอาแต่น้ำ นำมาเคี่ยวกับน้ำตาล หรือนำผลไม้สดมาปั่นผสมกับน้ำแข็ง น้ำเชื่อม จะได้รสชาติแปลกๆ หลายอย่าง
น้ำผลไม้เป็น เครื่องดื่มที่มีประโยชน์มากอย่างหนึ่ง และต้องเป็นน้ำผลไม้ที่สดๆ จึงจะได้คุณค่ามาก ผู้ผลิตมักจะนำผลไม้ที่มีมากในฤดูกาลมาคั้นเอาแต่น้ำ นำมาเคี่ยวกับน้ำตาล หรือนำผลไม้สดมาปั่นผสมกับน้ำแข็ง น้ำเชื่อม จะได้รสชาติแปลกๆ หลายอย่าง
3. สารทำความสะอาด
3.1 ความหมายของสารทำความสะอาด
สารทำความสะอาด หมายถึง คุณสมบัติในการกำจัดความสกปรกต่างๆ ตลอดจนฆ่าเชื้อโรค
สารทำความสะอาด หมายถึง คุณสมบัติในการกำจัดความสกปรกต่างๆ ตลอดจนฆ่าเชื้อโรค
3.2 ประเภทของสารทำความสะอาด
แบ่งตามการเกิด ได้ 2 ประเภท คือ
1) ได้จากการสังเคราะห์ เช่น น้ำยาล้างจาน สบู่ก้อน สบู่เหลว แชมพูสระผม ผงซักฟอก
สารทำความสะอาดพื้นเป็นต้น
1) ได้จากการสังเคราะห์ เช่น น้ำยาล้างจาน สบู่ก้อน สบู่เหลว แชมพูสระผม ผงซักฟอก
สารทำความสะอาดพื้นเป็นต้น
2) ได้จากธรรมชาติ เช่น น้ำมะกรูด มะขามเปียก เกลือ เป็นต้น
แบ่งตามวัตถุประสงค์ในการใช้งานเป็นเกณฑ์ แบ่งออกได้เป็น 4 ประเภท คือ
2.1 สารประเภททำความสะอาดร่างกาย ได้แก่ สบู่ แชมพูสระผม เป็นต้น
2.2 สารประเภททำความสะอาดเสื้อผ้า ได้แก่ สารซักฟอกชนิดต่างๆ
2.3 สารประเภททำความสะอาดภาชนะ ได้แก่ น้ำยาล้างจาน เป็นต้น
2.4 สารประเภททำความสะอาดห้องน้ำ ได้แก่ สารทำความสะอาดห้องน้ำทั้งชนิดผงและชนิดเหลว
สมบัติของสารทำความสะอาด
สารทำความสะอาดเช่น สบู่ แชมพูสระผม สารล้างจาน สารทำความสะอาดห้องน้ำ สารซักฟอก บางชนิดมีสมบัติเป็นกรด บางชนิดมีสมบัติเป็นเบสซึ่งทดสอบได้ด้วยกระดาษลิตมัส
สารทำความสะอาด ห้องน้ำและเครื่องสุขภัณฑ์บางชนิดมีสมบัติเป็นกรด สามารถกัดกร่อนหินปูนที่ยาไว้ระหว่างกระเบื้องปูพื้นหรือฝาห้องน้ำบริเวณ เครื่องสุขภัณฑ์ ทำให้คราบสกปรกที่เกาะอยู่หลุดลอกออกมาด้วย ถ้าใช้สารชนิดนี้ไปนานๆ พื้นและฝาห้องน้ำจะสึกกร่อนไปด้วย นอกจากนี้ ยังทำให้ผู้ใช้เกิดความระคายเคืองของระบบทางเดินหายใจและผิวหนังอีกด้วย ดังนั้น ในการใช้ต้องระมัดระวังโดยปฏิบัติตามคำแนะนำการใช้อย่างเคร่งครัดและต้องใช้ ในปริมาณที่เหมาะสม การใช้ในปริมาณมากเกินไป ไม่ได้หมายความว่าจะช่วยทำความสะอาดได้มากขึ้น ในทางตรงกันข้าม อาจทำให้สิ้นเปลืองและทำลายสิ่งแวดล้อม ส่วนสารทำความสะอาดห้องน้ำและเครื่องสุขภัณฑ์
2.1 สารประเภททำความสะอาดร่างกาย ได้แก่ สบู่ แชมพูสระผม เป็นต้น
2.2 สารประเภททำความสะอาดเสื้อผ้า ได้แก่ สารซักฟอกชนิดต่างๆ
2.3 สารประเภททำความสะอาดภาชนะ ได้แก่ น้ำยาล้างจาน เป็นต้น
2.4 สารประเภททำความสะอาดห้องน้ำ ได้แก่ สารทำความสะอาดห้องน้ำทั้งชนิดผงและชนิดเหลว
สมบัติของสารทำความสะอาด
สารทำความสะอาดเช่น สบู่ แชมพูสระผม สารล้างจาน สารทำความสะอาดห้องน้ำ สารซักฟอก บางชนิดมีสมบัติเป็นกรด บางชนิดมีสมบัติเป็นเบสซึ่งทดสอบได้ด้วยกระดาษลิตมัส
สารทำความสะอาด ห้องน้ำและเครื่องสุขภัณฑ์บางชนิดมีสมบัติเป็นกรด สามารถกัดกร่อนหินปูนที่ยาไว้ระหว่างกระเบื้องปูพื้นหรือฝาห้องน้ำบริเวณ เครื่องสุขภัณฑ์ ทำให้คราบสกปรกที่เกาะอยู่หลุดลอกออกมาด้วย ถ้าใช้สารชนิดนี้ไปนานๆ พื้นและฝาห้องน้ำจะสึกกร่อนไปด้วย นอกจากนี้ ยังทำให้ผู้ใช้เกิดความระคายเคืองของระบบทางเดินหายใจและผิวหนังอีกด้วย ดังนั้น ในการใช้ต้องระมัดระวังโดยปฏิบัติตามคำแนะนำการใช้อย่างเคร่งครัดและต้องใช้ ในปริมาณที่เหมาะสม การใช้ในปริมาณมากเกินไป ไม่ได้หมายความว่าจะช่วยทำความสะอาดได้มากขึ้น ในทางตรงกันข้าม อาจทำให้สิ้นเปลืองและทำลายสิ่งแวดล้อม ส่วนสารทำความสะอาดห้องน้ำและเครื่องสุขภัณฑ์
4. สารกำจัดแมลง และสารกำจัดศัตรูพืช
4.1 ความหมายของสารกำจัดแมลงและสารกำจัดศัตรูพืช สารกำจัดแมลงและสารกำจัดศัตรูพืช หมายถึง สารเคมีที่ผลิตขึ้นเพื่อใช้ป้องกันการกำจัด และควบคุมแมลงต่างๆ ไม่ให้มารบกวน มีทั้งชนิดผง ชนิดเม็ด และชนิดน้ำ
4.1 ความหมายของสารกำจัดแมลงและสารกำจัดศัตรูพืช สารกำจัดแมลงและสารกำจัดศัตรูพืช หมายถึง สารเคมีที่ผลิตขึ้นเพื่อใช้ป้องกันการกำจัด และควบคุมแมลงต่างๆ ไม่ให้มารบกวน มีทั้งชนิดผง ชนิดเม็ด และชนิดน้ำ
4.2 ประเภทของ สารกำจัดแมลงและสารกำจัดศัตรูพืช แบ่งเป็น 2 ประเภท คือ
1. ได้จากการสังเคราะห์ เช่น สารฆ่ายุง สารกำจัดแมลง เป็นต้น
1. ได้จากการสังเคราะห์ เช่น สารฆ่ายุง สารกำจัดแมลง เป็นต้น
2. ได้จากธรรมชาติ เช่น เปลือกมะนาว เปลือกมะกรูด เปลือกส้ม เป็นต้น
5.เครื่องสำอาง
5.1 ความหมายของเครื่องสำอาง
เครื่องสำอาง หมายถึง ผลิตภัณฑ์ที่ใช้ทา ถู นวด โรย พ่น หยอด ใส่ อบร่างกาย เพื่อใช้ทำความสะอาดเพื่อให้เกิดความสดชื่น ความสวยงาม และเพิ่มความมั่นใจ
เครื่องสำอาง หมายถึง ผลิตภัณฑ์ที่ใช้ทา ถู นวด โรย พ่น หยอด ใส่ อบร่างกาย เพื่อใช้ทำความสะอาดเพื่อให้เกิดความสดชื่น ความสวยงาม และเพิ่มความมั่นใจ
5.2 ประเภทของเครื่องสำอาง แบ่งเป็น 5 ประเภท คือ
1 ) สำหรับผม เช่น แชมพู ครีมนวด เจลแต่งผม ฯลฯ
2 ) สำหรับร่างกาย เช่น สบู่ ครีม และโลชั่นทาผิว ยาทาเล็บ น้ำยาดับกลิ่นตัว แป้งโรยตัว ฯลฯ
3 ) สำหรับใบหน้า เช่น ครีม โฟมล้างหน้า แป้งผัดหน้า ลิปสติก ดินสอเขียนคิ้วและดินสอเขียนขอบตา
4 ) น้ำหอม
5 ) เบ็ดเตล็ด เช่น ครีมโกนหนวด ผ้าอนามัย ยาสีฟัน ฯลฯ
1 ) สำหรับผม เช่น แชมพู ครีมนวด เจลแต่งผม ฯลฯ
2 ) สำหรับร่างกาย เช่น สบู่ ครีม และโลชั่นทาผิว ยาทาเล็บ น้ำยาดับกลิ่นตัว แป้งโรยตัว ฯลฯ
3 ) สำหรับใบหน้า เช่น ครีม โฟมล้างหน้า แป้งผัดหน้า ลิปสติก ดินสอเขียนคิ้วและดินสอเขียนขอบตา
4 ) น้ำหอม
5 ) เบ็ดเตล็ด เช่น ครีมโกนหนวด ผ้าอนามัย ยาสีฟัน ฯลฯ
RETURN TO CONTENTS
ธาตุและสารประกอบในอุตสาหกรรม
ประเทศไทยเป็นประเทศที่อุดมสมบูรณ์ไปด้วยทรัพยากรณ์มากมาย ทั้งป่าไม้ แร่ธาตุ ซึ่งก็มีการทำอุตสาหกรรมต่างๆ ที่เกี่ยวข้องกับแร่ธาตุและสารประกอบที่มีความจำเป็นในอุตสาหกรรม และได้นำหลักการทางเคมีมาใช้ในอุตสาหกรรมเหล่านี้เพื่อให้กระบวนการผลิตมี ประสิทธิภาพมากขึ้น
1. อุตสาหกรรมแร่
แร่ (Mineral)คือสารประกอบอนินทรีย์ (Inorganic) ที่เกิดขึ้นเองตามธรรมชาติ มีโครงสร้างและส่วนประกอบที่แน่นอน และมีสมบัติต่างๆ เฉพาะตัว
สินแร่คือหิน หรือแร่ประกอบหินที่มีแร่ที่มีค่าทางเศรษฐกิจปริมาณมากพอที่จะสามารถนำมา ถลุง และนำไปใช้ประโยชน์ได้ หรือแร่จากเหมืองที่ยังไม่ได้ถลุง นั่นเอง โดยทั่วไป แร่ของโลหะมักอยู่ในรูปของออกไซด์ ซัลไฟด์ เฮไลด์ ซิลิเกต คาร์บอเนต และซัลเฟต
ตารางที่ 1 ชนิดของสารประกอบบางชนิดของแร่ที่พบ
ไอออนลบ
|
ตัวอย่างและชื่อของแร่
|
ไม่เกิดไอออนลบ
(เป็นโลหะอิสระ)
|
Au, Ag, Pt, Os, Ir, Ru, Rh, Pd, As, Sb, Bi, Cu
|
ออกไซด์
|
ฮีมาไทต์Fe2O3แมกนีไทต์ Fe3O4บอกไซต์ Al2O3ซิลิกา SiO2
|
ซัลไฟด์
|
สฟาเลอไรต์ ZnS กาลีนา PbS คาลโคไพไรต์ CuFeS2คาลโคไซต์ Cu2S
|
คลอไรด์
|
เกลือหิน NaClซิลไวท์ KClคาร์นาไลต์ KCl.MgCl2
|
คาร์บอเนต
|
หินปูน CaCO3แมกนีไซด์ MgCO3โคโลไมต์ MgCO3.CaCO3
|
ซัลเฟต
|
ยิบซัม CaSO4.2H2O ดีเกลือ MgSO4.7H2O บาไรต์ BaSO4
|
ซิลิเกต
|
เบริล Be3Al2Si6O18คาโอลิไนต์ Al2(Si2O8)(OH)4
|
ที่มา: Whitten Kenneth, et al, General Chemistry with Qualitative Analysis, 4th ed, 1992; P 837.
ประเภทของแร่จำแนกตามประโยชน์ที่ใช้ในทางเศรษฐกิจได้ 2 ประเภทดังนี้
1. แร่ประกอบหิน(Mineral rock)
คือ หินที่มีแร่เป็นส่วนประกอบ เช่น
หินแกรนิตประกอบด้วย แร่ควอร์ต เฟลด์สปา และไมกา
หินปูนประกอบด้วยแร่แคลไซด์ และอื่นๆ
http://www.rmutphysics.com/charud/specialnews/5/element/1.jpg
รูปที่ 1หินแกรนิตและหินปูน
2. แร่เศรษฐกิจและอุตสาหกรรม (Industrial mineral)
คือแร่ที่มีคุณค่าทางเศรษฐกิจหรือทางอุตสาหกรรม แบ่งเป็น 2 ประเภท คือ
1. แร่โลหะ (Metallic mineral)เช่น แร่เงิน ทองแดง สังกะสี เหล็ก ตะกั่ว ดีบุก ทังสเตน และอะลูมิเนียม
2. แร่อโลหะ (Nonmetallic mineral)เช่น แร่เฟลด์สปา แกรไฟต์ ดินขาว ใยหิน ฟอสเฟต ยิบซัม รัตนชาติ ทราย และแร่เชื้อเพลิง
แร่ทองคำแร่เงินแร่เหล็กยิบซัม แกรไฟต์
รูปที่ 2 แร่เศรษฐกิจและอุตสาหกรรมต่างๆ
วิธีการสกัดโลหะออกจากแร่มี 3 ขั้นตอน ดังนี้
1. Concentration
คือ การนำสินแร่มาแยกสิ่งเจือปนไม่บริสุทธิ์ออก นั่นก็คือการทำให้แร่มีความเข้มข้นมากขึ้น นั่นเอง โดยอาศัยสมบัติทางกายภาพและทางเคมีก็ได้
2.Reduction
เป็น ขั้นตอนการถลุง ทำให้โลหะออกจากแร่โดยการรีดิวซ์สารประกอบของโลหะที่อุณหภูมิสูง โลหะที่แยกออกมาจะอยู่ในลักษณะที่หลอมเหลวและในขั้นตอนการถลุงนี้จะเติมสาร บางชนิดที่เรียกว่า flux เช่น แคลเซียมคาร์บอเนตลงไปเพื่อรวมกับสิ่งเจือปนที่อาจเหลืออยู่ให้ตกตะกอน (Slag) ออกมา ตัวรีดิวซ์ที่นิยมใช้ คือถ่านโค้ก เพราะหาง่าย ราคาถูก
3. Electrorefining
เป็น การทำโลหะที่ถลุงให้บริสุทธิ์ โดยกระบวนการอิเล็กโทรไลซิส ทำให้โลหะบริสุทธิ์ขึ้นอีกระดับหนึ่ง ซึ่งมีความบริสุทธิ์ประมาณ 99.6%
2. อุตสาหกรรมเซรามิกส์
เซรามิกส์ (Ceramics) คือผลิตภัณฑ์ ที่ทำจากดิน และผ่านการเผามาแล้ว เช่น เครื่องลายคราม อิฐทนไฟ กระเบื้องปูพื้น เครื่องปั้นดินเผา แก้ว วัสดุทนไฟต่างๆ และเครื่องสุขภัณฑ์
เครื่องปั้นดินเผาเป็นเซรามิกส์ประเภทหนึ่ง ซึ่งได้มีการพัฒนาวัตถุดิบที่ใช้และสีสำหรับเคลือบให้มีประสิทธิภาพมากยิ่งขึ้น
วัสดุที่ใช้ในการผลิตเซรามิกส์เช่น ดินขาว ดินเหนียว เฟลด์สปา ควอร์ตซ์ ทัลด์ หินปูน เซอร์โคเนียมออกไซด์ โซเดียมซิลิเกต และซิงค์ออกไซด์
ปัจจุบันวิทยาศาสตร์และเทคโนโลยีเจริญก้าวหน้ามากยิ่งขึ้น โดยผลิตภัณฑ์เซรามิกส์ในปัจจุบันได้มีการใช้เทคโนโลยีใหม่ๆ ในการผลิตจากสารอนินทรีย์ ซึ่งทำให้มีคุณสมบัติในการทนความร้อน ทนต่อปฏิกิริยาเคมี และมีคุณสมบัติทางไฟฟ้าที่ใช้เป็นฉนวนไฟฟ้าได้ ทำแผ่นและวงจรรวม (IC) ทำแผ่นซิลิกอนในเซลล์สุริยะ ผลิตตัวถังรถยนต์ เพื่อให้มีคุณสมบัติเบา แข็งแรง ทนสารเคมี การผลิตเซรามิกส์มักจะใช้สารตะกั่วในการช่วยให้สีเคลือบมีสีสดใส ถ้าผลิตไม่ได้คุณภาพ และมีการนำไปใส่อาหารที่เป็นกรด หรือเบส อาจทำให้ตะกั่วละลายออกมา และปนเปื้อนกับอาหารได้
3. อุตสาหกรรมปุ๋ย
ปุ๋ยคือ สารหรือวัสดุที่มีธาตุอาหารของพืช ซึ่งพืชต้องการใช้ในการเจริญเติบโต เพื่อเพิ่มธาตุอาหารให้แก่ดิน แบ่งได้เป็น2ประเภท คือ
1. ปุ๋ยอนินทรีย์เป็นปุ๋ยส่วนใหญ่ได้มาจากการสังเคราะห์ทางวิทยาศาสตร์ จึงเรียกว่าปุ๋ยวิทยาศาสตร์ เช่น ปุ๋ยแอมโมเนียมคลอไรด์ ปุ๋ยยูเรีย ปุ๋ยฟอสเฟต เป็นต้น
2. ปุ๋ยอินทรีย์เป็นปุ๋ยที่ได้จากซากพืชซากสัตว์ เช่น ปุ๋ยคอก ปุ๋ยหมัก ปุ๋ยพืชสด ปุ๋ยชีวภาพ
หมายเหตุ
ปุ๋ยวิทยาศาสตร์คือ ปุ๋ยที่มีธาตุที่จำเป็นแก่การเจริญเติบโตของพืชเป็นส่วนประกอบ เช่น N, P,K และ Caส่วนธาตุอาหารรอง คือ S, Mg, Fe, Zn, Mn และ Cu เป็นต้น
ตัวอย่างปุ๋ยวิทยาศาสตร์คือปุ๋ยแอมโมเนียมซัลเฟต ปุ๋ยยูเรีย ปุ๋ยแคลเซียมฟอสเฟต ปุ๋ยซุปเปอร์ฟอสเฟต และปุ๋ยโพแทสเซียม
สำหรับปุ๋ยอินทรีย์มีหลายชนิด คือ
ปุ๋ยคอกได้จากมูลสัตว์ต่างๆ ที่ปล่อยให้ย่อยสลายเองตามธรรมชาติ
ปุ๋ยหมักได้จากการนำขยะมูลฝอย เศษอาหาร และสิ่งปฏิกูลทั้งหลายมาย่อยสลายด้วยจุลินทรีย์
ประโยชน์ของปุ๋ยหมัก คือ
1. ช่วยเพิ่มปริมาณอินทรีย์วัตถุให้แก่ดิน ทำให้ดินอุดมสมบูรณ์
2.ช่วยเปลี่ยนสภาพของดินจากดินเหนียวหรือดินทรายเป็นดินร่วน ทำให้สะดวกในการไถพรวน
3. ช่วยรักษาความชื้นในดินได้ดีขึ้น
4. ช่วยให้อากาศในดินถ่ายเทได้มากขึ้น
5. ช่วยเพิ่มประสิทธิภาพในการใช้ปุ๋ยเคมี และลดการใช้ปุ๋ยเคมีลงได้
6. ช่วยกระตุ้นให้ธาตุอาหารพืชบางชนิดในดินที่ละลายน้ำยากให้ละลายน้ำได้ง่ายเป็นอาหารแก่พืชได้มากยิ่งขึ้น
7. ไม่เป็นอันตรายต่อดินแม้จะใช้ปริมาณมากๆ ติดต่อกันนานๆ
8. ช่วยปรับสภาพแวดล้อม เช่น กำจัดขยะมูลฝอย และวัชพืชน้ำทั้งหลายให้หมดไป
ปุ๋ยพืชสด คือ
1.เพิ่มอินทรียวัตถุและปริมาณไนโตรเจนให้กับดิน
2.ช่วยให้ดินร่วนซุย อุ้มน้ำและจับยึดปุ๋ยเคมีได้ดีขึ้น
3.เพิ่มผลผลิต และคุณภาพของผลผลิตให้ดีขึ้น
อ้างอิง
ความคิดเห็น
แสดงความคิดเห็น