บทเรียนที่ 1 ความหมายของพันธะเคมี
แรงยึดเหนี่ยวทางเคมี
ในชีวิตประจำวันทั่วๆไปจะพบว่าสารชนิดหนึ่งๆมักจะอยู่รวมกันเป็นกลุ่มก้อนและเมื่อต้องการทำให้แยกออกจากกันจะต้องใช้พลังงานจำนวนหนึ่งตัวอย่างเช่น
1. เมื่อให้ความร้อนแก่สารจนกระทั่งโมเลกุลของสารมีพลังงานสูงพอจะทำให้เกิด
- การเปลี่ยนสถานะ น้ำแข็ง(ให้พลังงานความร้อน)เปลี่ยนสถานะเป็นน้ำ(ของเหลว) ให้พลังงานความร้อนเปลี่ยนสถานะเป็นไอน้ำ
- สารบางชนิดอาจแยกสลายออกเป็นสารหลายชนิดได้
2. เมื่อให้พลังงานไฟฟ้าโมเลกุลของสารบางชนิดจะสลายตัวให้ธาตุที่เป็นองค์ประกอบ เช่นการแยกน้ำด้วยไฟฟ้า
จากข้อมูลข้างต้น แสดงว่ามีแรงยึดเหนี่ยวระหว่างโมเลกุล และแรงยึดเหนี่ยวระหว่างอะตอมที่เป็นองค์ประกอบของโมเลกุล
เราสามารถแบ่งแรงยึดเหนี่ยวออกเป็น 2 ประเภทดังนี้
1. แรงยึดเหนี่ยวภายในโมเลกุล (พันธะเคมี) อะตอม - อะตอมได้แก่
- พันธะโคเวเลนต์ (covelent bond)
- พันธะไอออนิก (ionic bond)
- พันธะโลหะ (metallic bond)
2. แรงยึดเหนี่ยวระหว่างโมเลกุล โมเลกุล -โมเลกุล ได้แก่
- แรงแวนเดอร์วาลส์ (vanderwaal force)
- แรงดึงดูดระหว่างขั้ว (dipole-dipole interation)
- พันธะไฮโดรเจน (hydrogen bond)
พันธะเคมี
พันธะเคมีคือ แรงยึดเหนี่ยวระหว่างอะตอมกับอะตอมภายในโมเลกุลเป็นแรงยึดเหนี่ยวระหว่างอะตอมที่ทำให้เกิดโมเลกุลของสาร
กฎออกเตด (Octet rule)
จากการศึกษาเกี่ยวกับธาตุก๊าซเฉื่อย เช่น He Ne Ar Kr พบว่าเป็นธาตุที่โมเลกุลเป็นอะตอมเดี่ยว คือในหนึ่งโมเลกุลของก๊าซเฉื่อยจะมีเพียง 1 อะตอม แสดงว่าเป็นธาตุที่เสถียรมาก ทำให้นักวิทยาศาสตร์สนใจที่จะค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร และจากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือมี 8 อิเล็กตรอน(ยกเว้น He มี 2 อิเล็กตรอน) เช่น
2He =210Ne = 2 ,818Ar = 2 , 8 ,836Kr = 2 , 8 , 18 ,8
ส่วนธาตุหมู่อื่นมีการจัดเรียงอิเล็กตรอนในระดับพลังงานชั้นนอกสุด ไม่ครบ 8 เช่น
1H =16C = 2 ,47N = 2 ,58O = 2 ,6
ธาตุที่มีวาเลนต์อิเล็กตรอนไม่ครบ 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยวๆได้ ซึ่งแสดงว่าไม่เสถียร ต้องรวมกันเป็นโมเลกุลซึ่งอาจจะมี 2 อะตอมหรือมากกว่า
การที่อะตอมของธาตุต่างๆ รวมตัวกันด้วยสัดส่วนที่ทำให้วาเลนต์อิเล็กตรอนเท่ากับ 8 นี้ นักวิทยาศาสตร์ได้ตั้งเป็นกฎขึ้นเรียกว่า กฎออกเตต
การรวมกันเพื่อทำให้อะตอม มีวาเลนต์อิเล็กตรอนครบ 8 อาจมีลักษณะดังนี้
- อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันเป็นคู่ๆ จะเกิด"พันธะโคเวเลนต์ "
- อะตอม ให้หรือรับอิเล็กตรอน จะเกิดเป็น" พันธะไอออนิค"
- อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันทั้งก้อน จะเกิดเป็น" พันธะโลหะ "
(ความแข็งแรงของพันธะพันธะโลหะ > พันธะไอออนิค > พันธะโคเวเลนต์)
RETURN TO CONTENTS
บทเรียนที่ 2 การเกิดพันธะโคเวเลนต์
พันธะโคเวเลนต์ (Covalent bond) มาจากคำว่า co + valence electron ซึ่งหมายถึง พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน ดังเช่น ในกรณีของไฮโดรเจน ดังนั้นลักษณะที่สำคัญของพันธะโคเวเลนต์ก็คือการที่อะตอมใช้เวเลนต์อิเล็กตรอนร่วมกันเป็นคู่ ๆ
สารประกอบที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าสารโคเวเลนต์
โมเลกุลของสารที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าโมเลกุลโคเวเลนต์
การเกิดพันธะโคเวเลนต์
ดังที่ได้กล่าวไว้แล้วว่าพันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ
- ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะเดี่ยวเช่น ในโมเลกุลของไฮโดรเจน
- ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะคู่เช่น ในโมเลกุลของออกซิเจน
- ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะสามเช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ BeCl2เป็นต้น
การเขียนสูตรและการเรียกชื่อสารโคเวเลนต์
สูตรเคมี หมายถึงสัญลักษณ์ที่ใช้เพื่อแสดงว่าสารประกอบนั้นมีธาตุอะไรบ้างเป็นองค์ประกอบอย่างละกี่อะตอม สูตรเคมีแบ่งออกเป็น 3 ประเภทคือ
1. สูตรโมเลกุลเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้างอย่างละกี่อะตอม เช่น สูตรโมเลกุลของน้ำตาลกลูโคส คือ C6H12O6แสดงว่ากลูโคสประกอบด้วยธาตุ C , H และ O จำนวน 6 , 12 และ 6 อะตอมตามลำดับ
สำหรับสูตรโมเลกุล ของสารโคเวเลนต์โดยทั่วไป จะเขียนสัญลักษณ์ของธาตุในโมเลกุล เรียงลำดับคือ B , Si, C , P , H , S , I , Sr , Cl , O และ F เช่น ClF OF2, CO2เป็นต้น
2. สูตรอย่างง่ายเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง มีอัตราส่วนของจำนวนอะตอมเป็นเท่าใด เช่น สูตรอย่างง่ายของกลูโคสคือ CH2O ซึ่งแสดงว่ากลูโคสประกอบด้วยธาตุ C, H และ O โดยมีอัตราส่วนอะตอมของ C : H : O = 1: 2 : 1
3. สูตรโครงสร้างเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง อย่างละกี่อะตอมและแต่ละอะตอมยึดเหนี่ยวกันด้วยพันธะเคมีอย่างไร จะเห็นได้ว่าสูตรโครงสร้างของสารให้ราบละเอียดเกี่ยวกับองค์ประกอบของธาตุต่าง ๆ ในโมเลกุลมากกว่าสูตรอย่างง่ายและสูตรโมเลกุล
สูตรโครงสร้างสามารถเขียนได้ 2 แบบ คือ สูตรโครงสร้างแบบจุด (electron dot formula) หรือสูตรโครงสร้างแบบลิวอิส (Lwwis formula) และสูตรโครงสร้างแบบเส้น (graphic formula) สูตรโครงสร้างทั้ง 2 แบบจะแสดงเฉพาะเวเลนต์อิเล็กตรอนของอะตอมคู่ร่วมพันธะ
ก. สูตรโครงสร้าง
ใช้สัญลักษณ์เป็นจุด ( . ) แทนเวเลนต์อิเล็กตรอนโดยเขียนไว้รอบ ๆ สัญลักษณ์ของธาตุ หรืออาจจะใช้สัญลักษณ์เป็น x แทนเวเลนต์อิเล็กตรอนก็ได้เพื่อให้เห็นความแตกต่างระหว่างอิเล็กตรอนของธาตุคู่ร่วมพันธะต่างชนิดกัน
โดยทั่ว ๆ ไปการเขียนสูตรแบบจุดจะมีข้อกำหนดดังนี้
1. อะตอมของธาตุก่อนเขียน ให้เขียนแยกกัน และเขียนจุด ( . ) แสดงเวเลนต์อิเล็กตรอนล้อมรอบสัญลักษณ์ของธาตุ โดยมีจำนวนจุดเท่ากับจำนวนเวเลนต์อิเล็กตรอน เช่น
1H มี 1 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น
8O มี 6 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น
15P มี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น
2. เมื่ออะตอม 2 อะตอมสร้างพันธะโคเวเลนต์ ให้เขียนสูตรแบบจุดของอะตอมทั้งสองไว้ด้วยกัน สำหรับอิเล็กตรอนที่ใช้ร่วมกัน ให้เขียนจุด ( . ) ไว้ในระหว่างสัญลักษณ์ของอะตอมคู่ร่วมพันธะ ส่วนอิเล็กตรอนที่ไม่ได้ร่วมกัน หรืออิเล็กตรอนที่ไม่ได้ใช้ในการสร้างพันธะ ให้เขียนด้วยจุดไว้บนอะตอมเดิม
จะเห็นได้ว่าการเขียนสูตรแบบจุดจำเป็นที่จะต้องทราบจำนวนเวเลนต์อิเล็กตรอนของธาตุคู่ร่วมพันธะก่อนซึ่งอาจจะทราบจากเลขอะตอมของธาตุ หลังจากนั้นจึงจะนำมาเขียนเป็นสูตรแบบจุด
ตัวอย่างเช่น
1. สูตรแบบจุดของไฮโดรเจน (H2)
1H มี 1 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น เมื่อ 2 อะตอมรวมกันเป็นโมเลกุล จะมีการใช้เวเลนต์อิเล็กตรอนร่วมกัน 1 คู่ จึงเขียนสูตรแบบจุดได้ดังนี้
2. สูตรแบบจุดของก๊าซไฮโดรเจนฟลูออไรด์ (HF)
9F มีการจัดเรียงอิเล็กตรอนเป็น 2 , 7
ดังนั้นมี 7 เวเลนต์อิเล็กตรอน สูตรแบบจุดคือ
เมื่อ H รวมกับ F เป็น HF เขียนเป็นสูตรแบบจุดได้ดังนี้
H และ F ใช้อิเล็กตรอนร่วมกันเพียง 1 คู่ในโมเลกุลของ HF จึงมีพันธะโคเวเลนต์เพียง 1 พันธะ โดยเขียนอิเล็กตรอนที่ใช้ร่วมกันไว้ระหว่างธาตุ H กับ F สำหรับอิเล็กตรอนที่เหลือของ F 6 อิเล็กตรอนก็เขียนไว้บนอะตอมของ F
3. สูตรแบบจุดของก๊าซไฮโดรเจนซัลไฟด์ (H2S)
กำมะถันมีเลขอะตอมเท่ากับ 16
เพราะฉะนั้นมีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 6
16S จึงมี 6 เวเลนต์อิเล็กตรอน สูตรแบบจุดคือ
เมื่อ H รวมกับ S เป็น H2S เขียนสูตรแบบจุดได้เป็นดังนี้
ในโมเลกุลของ H2S มีการใช้อิเล็กตรอนร่วมกันระหว่าง H กับ S 2 คู่ ดังนั้นในโมเลกุลของ H2S จึงมีพันธะโคเวเลนต์ 2 พันธะ ซึ่งอิเล็กตรอนที่ใช้ร่วมกันทั้ง 2 คู่ได้เขียนไว้ระหว่างอะตอมของ H กับ S ส่วนอิเล็กตรอนที่เหลือของ S 4 อิเล็กตรอนให้เขียนไว้บนอะตอมของ S
4. สูตรแบบจุดของก๊าซแอมโมเนีย (NH3)
ไนโตรเจนเป็นธาตุหมู่ที่ 5 มีเลขอะตอมเท่ากับ 7
เพราะฉะนั้นมีการจัดเรียงอิเล็กตรอนเป็น 2 , 5
7N จึงมี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้ดังนี้
เมื่อ N รวมกับ H เป็น NH3เขียนสูตรแบบจุดได้ดังนี้
จะเห็นได้ว่าในโมเลกุลของ NH3มีการใช้อิเล็กตรอนร่วมกันระหว่าง H กับ N 3 คู่จึงพันธะโคเวเลนต์ 3 พันธะ
5. สูตรแบบจุดของฟอสฟอรัสไตรคลอไรด์ (PCl3)
P มีเลขอะตอมเท่ากับ 15
เพราะฉะนั้น P มีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 5
15P จึงมี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น
Cl มีเลขอะตอมเท่ากับ 17
เพราะฉะนั้น Cl มีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 7
17Cl จึงมี 7 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น
เมื่อ Cl 3 อะตอม รวมตัวกับ P 1 อะตอม เกิดเป็นสารประกอบโคเวเลนต์ PCl3จะเขียนสูตรแบบจุดได้ดังนี้
ในโมเลกุลของ PCl3มีการใช้อิเล็กตรอนร่วมกันระหว่างธาตุ P กับ Cl รวม 3 คู่เกิดเป็นพันธะโคเวเลนต์ 3 พันธะ
ข. สูตรโครงสร้างแบบเส้น
เป็นการเขียนสูตรโครงสร้างของโมเลกุลโคเวเลนต์อีกแบบหนึ่งซึ่งแตกต่างจากสูตรแบบจุดเล็กน้อย โดยกำหนดให้ใช้เส้นตรง ( - ) แทนอิเล็กตรอนคู่ร่วมพันธะ 1 คู่ หรือแทนพันธะโคเวเลนต์ 1 พันธะ ทั้งนี้ให้เขียนไว้ในระหว่างสัญลักษณ์ของธาตุคู่ร่วมพันธะ สำหรับอิเล็กตรอนที่ไม่ใช่อิเล็กตรอนคู่ร่วมพันธะจะเขียนไว้หรือไม่เขียนก็ได้ (ปกติจะไม่เขียน) สูตรแบบเส้นจึงเป็นการกำหนดขึ้นมาเพื่อให้เขียนสูตรโครงสร้างได้สะดวก และง่ายขึ้น ทั้งนี้เพราะไม่จำเป็นต้องแสดงเวเลนต์อิเล็กตรอนทั้งหมดของธาตุคู่ร่วมพันะะ
- ให้ใช้เส้นตรง 1 เส้น ( - ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 1 คู่
- ให้ใช้เส้นตรง 2 เส้น ( = ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 2 คู่
- ให้ใช้เส้นตรง 3 เส้น ( ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 3 คู่
ตัวอย่างสูตรแบบเส้น
1. สูตรแบบเส้นของก๊าซไฮโดรเจน (H2)
สูตรแบบจุดของ H2คือ H : H
จะเห็นได้ว่า H ทั้งสองอะตอมใช้อิเล็กตรอนร่วมกัน 1 คู่จึงใช้เส้นตรง 1 เส้นเขียนแทนอิเล็กตรอนคู่ร่วมพันธะ โดยเขียนไว้ระหว่าง H ทั้งสองอะตอม
เพราะฉะนั้นสูตรโครงสร้างแบบเส้นของ H2จึงเป็น H - H
2. สูตรโครงสร้างแบบเส้นของก๊าซไฮโดรเจนฟลูออไรด์ (HF)
สูตรแบบจุดของ HF คือ
จะเห็นได้ว่าอะตอม H กับ F มีการใช้อิเล็กตรอนร่วมกันเพียง 1 คู่ จึงใช้เส้นตรง 1 เส้นแทนอิเล็กตรอนคู่ร่วมพันธะ
เพราะฉะนั้นสูตรแบบเส้นของ HF จึงเป็น H - F
3. สูตรแบบเส้นของก๊าซไฮโดรเจนซัลไฟด์ (H2S)
สูตรแบบจุดของ H2S คือ
จะเห็นได้ว่า H และ S ใช้อิเล็กตรอนร่วมกัน 1 คู่จึงใช้เส้นตรง 1 เส้นแทนอิเล็กตรอนคู่ร่วมพันธะ 1 คู่
ในโมเลกุลของ H2S จึงมี 2 พันธะโคเวเลนต์
เพราะฉะนั้น สูตรแบบเส้นของ H2S คือ H - S - H
4.สูตรแบบเส้นของก๊าซแอมโมเนีย (NH3)
สูตรแบบจุดของ NH3คือ
เพราะฉะนั้นสูตรแบบเส้น ของ NH3จึงเป็น
5. สูตรแบบเส้นของฟอสฟอรัสไตรคลอไรด์ (PCl3)
สูตรแบบจุดคือ
เพราะฉะนั้นเขียนสูตรแบบเส้นได้เป็น
หมายเหตุ
ก. การเขียนสูตรโครงสร้างแสดงพันธะโคเวเลนต์ทั้ง 2 แบบนี้เป็นเพียงสูตรที่เขียนขึ้นเพื่อความสะดวกเท่านั้นไม่ได้แสดงตำแหน่งที่แน่นอนของอิเล็กตรอน อิเล็กตรอนที่ใช้ร่วมกันซึ่งเขียนไว้ระหว่างอะตอมคู่ร่วมพันธะ ก็ไม่ได้หมายความว่าอิเล็กตรอนทั้งคู่จะต้องอยู่ระหว่างนิวเคลียสทั้งสองตลอดเวลา อิเล็กตรอนทั้งคู่อาจจะไปอยู่ส่วนอื่น ๆ ของอะตอมได้ แต่อย่างไรก็ตามโอกาสที่จะพบอิเล็กตรอนทั้งคู่อยู่ ระหว่างนิวเคลียสทั้งสองมีมากกว่าบริเวณอื่น ๆ
ข. การเขียนสูตรโครงสร้างทั้งสองแบบนี้ จุดหรือเส้นเพียงแต่แสดงจำนวนพันธะที่แต่ละอะตอมสร้างขึ้น ไม่ได้แสดงตำแหน่งของพันธะหรือตำแหน่งที่แน่นอนของอิเล็กตรอน รวมทั้งไม่ได้แสดงโครงสร้างของโมเลกุล
RETURN TO CONTENTS
บทเรียนที่ 3 กฎออกเตต (Octet Rule)
จากการศึกษาเกี่ยวกับธาตุเฉื่อย เช่น He , Ne , Ar , Kr พบว่าเป็นธาตุที่จัดอยู่ในประเภทโมเลกุลอะตอมเดียวทุกสถานะ คือใน 1 โมเลกุลของธาตุเฉื่อยจะมีเพียง 1 อะตอมทั้งสถานะของแข็ง ของเหลว และก๊าซในธรรมชาติเกือบจะไม่พบสารประกอบของธาตุเฉื่อยเลย แสดงว่าธาตุเฉื่อยเป็นธาตุที่เสถียรมาก เกิดปฏิกิริยาเคมีกับธาตุอื่น ๆ ได้ยาก การที่ก๊าซเฉื่อยมีความเสถียรมาก ทำให้นักวิทยาศาสตร์สนใจที่จะค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร และจากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยพบว่าธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือ มี 8 เวเลนต์อิเล็กตรอน (ยกเว้นธาตุ He มี 2 เวเลนต์อิเล็กตรอน) เช่น
2He = 2
10Ne = 2 , 8
18Ar = 2 , 8 , 8
36Kr= 2 , 8 , 18 , 8
เมื่อเปรียบเทียบกับโครงสร้างอะตอมของธาตุอื่น ๆ เช่น H , O , N
1H = 1
8O = 2 , 6
7N = 2 , 5
ธาตุเหล่านี้มีเวเลนต์อิเล็กตรอนน้อยกว่า 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยว ๆ ได้ ซึ่งแสดงว่าไม่เสถียร ต้องรวมกันเป็นโมเลกุลซึ่งอาจจะมี 2 อะตอมหรือมากกว่า การที่ธาตุเฉื่อยมี 8 เวเลนต์อิเล็กตรอนแล้วทำให้เสถียรกว่าธาตุอื่น ๆ ซึ่งมีเวเลนต์อิเล็กตรอนไม่เท่ากับ 8 ทำให้นักวิทยาศาสตร์เชื่อว่าโครงสร้างของอะตอมที่มี 8 เวเลนต์อิเล็กตรอนเป็นสภาพที่อะตอมเสถียรที่สุด
ดังนั้นธาตุต่าง ๆ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 8 จึงพยายามปรับตัวให้มีโครงสร้างแบบธาตุเฉื่อย เช่น โดยการรวมตัวกันเป็นโมเลกุลหรือใช้อิเล็กตรอนร่วมกันเพื่อทำให้เวเลนต์อิเล็กตรอนเท่ากับ 8 ส่วนไฮโดรเจนจะพยายามปรับตัวให้มีเวเลนต์อิเล็กตรอนเท่ากับ 2 เหมือนธาตุ He
การที่อะตอมของธาตุต่าง ๆ รวมตัวกันด้วยสัดส่วนที่ทำให้มีเวเลนต์อิเล็กตรอนเท่ากับ 8 นี้ นักวิทยาศาสตร์ได้ตั้งเป็นกฎเรียกว่ากฎออกเตต
ดังนั้นธาตุต่าง ๆ จึงพยายามรวมตัวกัน เพื่อให้เป็นไปตามกฎออกเตต ซึ่งจะทำให้ได้สารประกอบหรือโมเลกุลที่อยู่ในสภาพที่เสถียร สำหรับการรวมตัวกันด้วยพันธะโคเวเลนต์จะมีการใช้เวเลนต์อิเล็กตรอนร่วมกันระหว่างอะตอมคู่ร่วมพันธะ อิเล็กตรอนที่ใช้ร่วมกันถือว่าเป็นอิเล็กตรอนของอะตอมคู่ร่วมพันธะทั้งสอง
เช่น F2 มีสูตรแบบจุดเป็น
อะตอมของ F มีเวเลนต์อิเล็กตรอนเท่ากับ 7
เมื่อเกิดพันธะโคเวเลนต์มีการใช้อิเล็กตรอนร่วมกัน 1 คู่ ซึ่งอิเล็กตรอนที่ใช้ร่วมกัน 1 คู่นี้ถือว่าเป็นของฟลูออรีนทั้ง 2 อะตอม ทำให้ฟลูออรีนแต่ละอะตอมใน F2มีเวเลนต์อิเล็กตรอนเท่ากับ 8
จำนวนเวเลนต์อิเล็กตรอนของธาตุแต่ละชนิดอาจจะแสดงให้เห็นได้ชัดเจนขึ้นโดยการเขียนวงกลมล้อมรอบแต่ละลอะตอม จำนวนอิเล็กตรอนที่อยู่ในวงกลมของธาตุใดก็จัดว่าเป็นของธาตุนั้น
เช่น
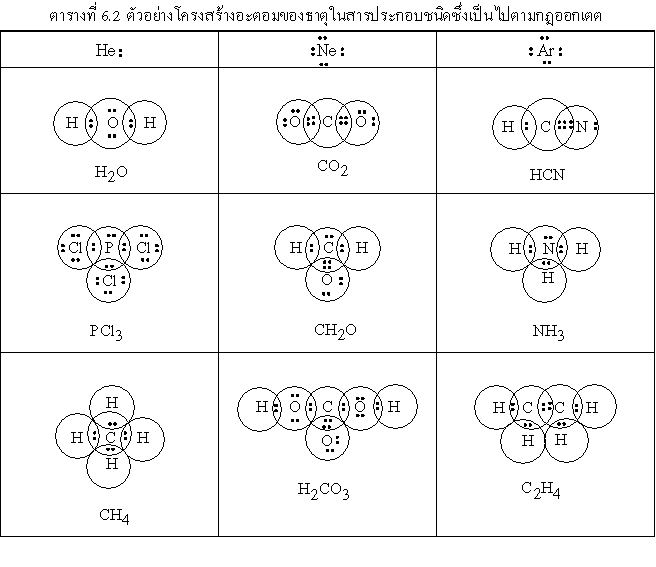
ข้อยกเว้นสำหรับกฎออกเตต
ดังที่ได้กล่าวมาแล้วว่าอะตอมของธาตุต่าง ๆ มักจะรวมตัวกันเป็นสารประกอบเพื่อให้เป็นไปตามกฎออกเตต ซึ่งจะทำให้สารประกอบนั้นอยู่ในสภาพที่เสถียร เช่น H2O , PCl3, NH3, CO2แต่อย่างไรก็ตามเมื่อมีการศึกษาให้กว้างขวางออกไปก็พบว่าสารประกอบบางชนิดมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามกฎออกเตต บางชนิดมีเวเลนต์อิเล็กตรอนน้อยกว่า 8 และบางชนิดมีเวเลนต์อิเล็กตรอนมากกว่า 8 ซึ่งสารต่าง ๆ เหล่านี้แม้ว่าจะไม่เป็นไปตามกฎออกเตต แต่ก็อยู่ในภาวะที่ไม่เสถึยร จัดว่าเป็นข้อยกเว้นสำหรับกฎออกเตต ซึ่งสรุปได้ดังนี้
ก. พวกที่ไม่ครบออกเตต
ได้แก่สารประกอบของธาตุในคาบที่ 2 ของตารางธาตุ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 4 เช่น4Be และ5B
4Be = 2 , 2 เวเลนต์อิเล็กตรอนเท่ากับ 2
5B = 2 , 3 เวเลนต์อิเล็กตรอนเท่ากับ 3
ธาตุ Be และ B เมื่อเกิดเป็นสารประกอบโคเวเลนต์ทั่ว ๆ ไปจะไม่ครบออกเตต
ตัวอย่างเช่น BF3, BCl3, BeCl2และ BeF2เป็นต้น
* ใน BF3ธาตุ B จะมีเวเลนต์อิเล็กตรอนเท่ากับ 6 ซึ่งไม่ครบออกเตต ในขณะที่ธาตุ F ครบออกเตต
* ใน BeCl2ธาตุ Be จะมีเวเลนต์อิเล็กตรอนเท่ากับ 4 ซึ่งไม่ครบออกเตต ในขณะที่ธาตุ Cl ครบออกเตต
แต่ถ้าธาตุเหล่านี้เกิดเป็นสารประกอบเชิงซ้อน บางชนิดจะเป็นไปตามกฎออกเตต เช่น BF4-, BCl3.NH3
- ใน BF4-ทั้ง B และ F ต่างก็มีเวเลนต์อิเล็กตรอนเท่ากับ 8 เป็นไปตามกฎออกเตต
- ใน BCl3.NH3ทั้ง B , Cl , N และ F ต่างก็เป็นไปตามกฎออกเตต
ข. พวกที่เกินกฎออกเตต
ตามทฤษฎีสารประกอบของธาตุที่อยู่ในคาบที่ 3 ของตารางธาตุเป็นต้นไป สารมารถสร้างพันธะแล้วทำให้อิเล็กตรอนเกิน 8 ได้ (ตามกฎการจัดอิเล็กตรอน 2n2ในคาบที่ 3 สามารถมีอิเล็กตรอนได้เต็มที่ถึง 18 อิเล็กตรอน) แต่อย่างไรก็ตามพวกที่เกินออกเตตมักจะพบในสารประกอบบางตัวของ P , S และโลหะทรานซิชัน เช่นใน PCl5, SF6, Fe(CN)63-, Co(NH3)62+, SiF62-และ Icl3เป็นต้น
- ใน PCl5ธาตุ P เกิดพันธะกับ Cl รวม 5 พันธะจึงมีเวเลนต์อิเล็กตรอนเท่ากับ 10 ซึ่งเกินออกเตต ( 1 พันธะหรือ 1 เส้นประกอบด้วย 2 อิเล็กตรอน) สำหรับ PCl3หรือสารประกอบอื่น ๆ ของธาตุ P ส่วนมากเป็นไปตามกฎออกเตต
- ใน SF6ธาตุ S เกิดพันธะกับ F รวม 6 พันธะจึงมีเวเลนต์อิเล็กตรอนเท่ากับ 12 ซึ่งเกินออกเตต แต่ใน SF2หรือสารประกอบอื่น ๆ ของธาตุ S ส่วนมากเป็นไปตามกฎออกเตต
- ใน ICl3ธาตุ I เกิดพันธะกับ Cl รวม 3 พันธะและมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ จึงรวมเป็น 10 อิเล็กตรอน ซึ่งเกินออกเตต แต่ ICl หรือสารประกอบอื่น ๆ ของ I ส่วนใหญ่เป็นไปตามกฎออกเตต
- ใน Co(NH3)62+ธาตุ Co เกิดพันธะกับ N ใน NH3รวม 6 พันธะจึงมีเวเลนต์อิเล็กตรอนเท่ากับ 12 ซึ่งเกินออกเตต
นอกจากสารประกอบที่ไม่เป็นไปตามกฎออกเตตดังที่ได้กล่าวมาแล้ว ยังมีสารประกอบอื่น ๆ อีกบางชนิดซึ่งไม่เป็นไปตามกฎออกเตต เช่น ออกไซด์บางตัวของธาตุไนโตรเจน ( NO และ NO2)และออกไซด์ของคลอรีน (ClO2) เป็นต้น ธาตุเหล่านี้ (N และ Cl) สามารถมีอิเล็กตรอนที่ไม่ได้จับคู่ หรืออิเล็กตรอนเดี่ยว (Unpaired electron) ซึ่งทำให้แสดงสมบัติเป็น paramagnetic ได้
- ใน NO ธาตุ N มีเพียง 7 อิเล็กตรอนซึ่งไม่เป็นไปตามกฎออกเตต
- ใน NO2ธาตุ N เกิดพันธะกับธาตุ O แต่มีอิเล็กตรอนเพียง 7 ซึ่งไม่ครบออกเตต
- ใน ClO2ธาตุ Cl เกิดพันธะกับธาตุ O แต่มีอิเล็กตรอนเพียง 7 ซึ่งไม่ครบออกเตต
ประโยชน์ของกฎออกเตต
กฎออกเตต นอกจากจะใช้สำหรับเขียนสูตรโครงสร้างสารแล้ว ยังสามารถใช้ช่วยทำนายสัดส่วนจำนวนอะตอมของธาตุที่ทำปฏิกิริยากัน และทำนายสูตรของสารประกอบต่าง ๆ ได้ ตัวอย่างเช่น
1. ทำนายว่าสารประกอบระหว่างธาตุคลอรีนกับธาตุฟลูออรีน ควรจะมีสูตรเป็น ClF
เนื่องจากธาตุ Cl และ F ต่างก็เป็นธาตุหมู่ที่ 7 จึงมีเวเลนต์อิเล็กตรอนเท่ากับ 7 ทั้ง Cl และ F ต่างก็ต้องการอีก 1 อิเล็กตรอนจึงจะครบออกเตต ดังนั้นจึงสร้างพันธะ 1 พันธะ แสดงว่า Cl กับ F ควรจะรวมกันเป็นสารประกอบโดยใช้อย่างละ 1 อะตอม
2. กรณีสารประกอบฟอสฟอรัสกับคลอรีน
โดยอาศัยกฎออกเตตจะทำนายได้ว่าสูตรของสารประกอบควรจะเป็น PCl3เพราะ ธาตุ P เป็นธาตุหมู่ที่ 5 มี 5 เวเลนต์อิเล็กตรอน ต้องการอีก 3 อิเล็กตรอน หรือต้องเกิด 3 พันธะ จึงจะครบออกเตต ในขณะที่ Cl เป็นธาตุหมูที่ 7 มี 7 เวเลนต์อิเล็กตรอน ต้องการอีกเพียง 1 อิเล็กตรอนหรือต้องการเกิดเพียง 1 พันธะก็จะครบออกเตต
เพื่อให้ทั้ง P และ Cl ครบออกเตต จึงต้องใช้ Cl 3 อะตอมต่อ P 1 อะตอม สูตรของสารประกอบจึงเป็น PCl3
3. กรณีของสารประกอบระหว่างไนโตรเจนกับไฮโดรเจน
โดยใช้กฎออกเตต จะทำนายได้ว่าสารประกอบควรจะเป็น NH3
ธาตุ N มี 5 เวเลนต์อิเล็กตรอน ต้องการอีก 3 อิเล็กตรอนจึงจะครบออกเตตซึ่งก็ทำได้โดยการเกิด 3 พันธะ ส่วนธาตุ H มี 1 เวเลนต์อิเล็กตรอนต้องการอีก 1 อิเล็กตรอนจึงจะครบ 2 อิเล็กตรอนเหมือนธาตุ He ซึ่งก็ทำได้โดยการเกิด 1 พันธะ
ดังนั้น N 1 อะตอมต้องการ 3 พันธะ จึงต้องรวมกับ H 3 อะตอม ซึ่งแต่ละอะตอมต้องการ 1 พันธะ เพื่อให้ทั้ง N และ H ครบออกเตต สูตรของสารประกอบจึงเป็น NH3
4. กรณีสารประกอบระหว่างคาร์บอนกับคลอรีน
โดยใช้กฎออกเตต จะทำนายได้ว่าสูตรของสารประกอบควรจะเป็น CCl4
ธาตุ C มี 4 เวเลนต์อิเล็กตรอน ต้องการอีก 4 อิเล็กตรอนจึงจะครบออกเตต ดังนั้นจึงต้องเกิด 4 พันธะ ส่วน ธาตุ Cl มี 7 เวเลนต์อิเล็กตรอน ต้องการอีก 1 อิเล็กตรอนจึงจะครบออกเตต ดังนั้นจึงต้องเกิด 1 พันธะ
เพราะฉะนั้น C 1 อะตอม ต้องการ 4 พันธะ จึงต้องรวมกับ Cl 4 อะตอม ซึ่งแต่ละอะตอมต้องการ 1 พันธะ จึงจะทำให้ C และ Cl ครบออกเตต
สูตรของสารประกอบจึงเป็น CCl4
5. กรณีสารประกอบระหว่างคาร์บอนกับกำมะถัน
โดยใช้กฎออกเตต จะทำนายได้ว่าสูตรของสารประกอบควรจะเป็น CS2
ธาตุ C มี 4 เวเลนต์อิเล็กตรอน ต้องการอีก 4 อิเล็กตรอนจึงจะครบออกเตต ดังนั้นจึงเกิด 4 พันธะ ส่วนธาตุ S มี 6 มีเวเลนต์อิเล็กตรอนต้องการอีก 2 อิเล็กตรอนจึงจะครบออกเตต ดังนั้นจึงเกิด 2 พันธะ
เพราะฉะนั้น C 1 อะตอมต้องการ 4 พันธะ จึงต้องรวมกับ S 2 อะตอม ซึ่งแต่ละอะตอมต้องการ 2 พันธะ เพื่อให้ทั้ง C และ S ครบออกเตต
สูตรของสารประกอบจึงเป็น CS2
RETURN TO CONTENTS
บทเรียนที่ 4 ทฤษฎีพันธะเวเลนซ์
ทฤษฎีพันธะวาเลนซ์สามารถใช้คาดคะเนรูปทรงเลขาคณิตของโมเลกุลได้ดี ส่วนทฤษฎีออร์บิทัลโมเลกุลชึคำนวณพลังงานที่เกี่ยวข้อง และใช้คาดคะเนสมบัติทางแม่เหล็กของโมเลกุลได้ อย่างไรก็ตาม ทั้งสองทฤษฎีต่างไม่สมบูรณ์แบบ และการพิจารณาทฤษฎีทั้งสองนี้ให้ละเอียดถี่ถ้วนเป็นเรื่องยุ่งยาก
พันธะโควาเลนท์ คือพันธะที่เกิดจากการใช้อิเล็กตรอนร่วมกัน ระหว่างอะตอม ตัวอย่าง เช่น ไฮโดรเจนมีเลขอะตอม 1 อิเล็กตรอนตัวเดียวอยู่ในออร์บิทัล 1 s ซึ่งเป็นอิเล็กตรอนเรียงเดี่ยวคอยจับคู่กับอิเล็กตรอนของอะตอมอื่น ถ้าไฮโดรเจนสองอะตอมเข้าใกล้กันในระยะที่ออร์บิทัล 1s เกยเชื่อมกัน อิเล็กตรอนของอะตอมทั้งสองเข้าคู่กัน ทำให้ออร์บิทัลของอะตอมทั้งสองแปรสภาพของออร์บิทัลโมเลกุล (molecular orbital) เกิดพันธะโควาเลนท์ขึ้นระหว่างไฮโดรเจนสองอะตอม ความยาวพันธะเท่ากัน 74 pm หรือ 0.74 อังสตรอม ดังรูป 1-8 ปรากฏการณ์นี้ ทำให้พลังงานของไฮโดรเจนลดลง เป็นผลให้โมเลกุลของไฮดรเจนอยู่ตัว ดังนั้นสภาวะปกติไฮโดรเจนอยู่ตัว ดังนั้นสภาวะแปกติไฮโดรเจนจะอยู่ในสภาพโมเลกุล
| รูปที่ 1-8แสดงการรวมออร์บิทัลอะตอมของไฮโดรเจนสองอะตอมเป็นออร์บิทัลโมเลกุลของไฮโดรเจน |
รูปที่ 1-9แสดงระดับพลังงานระหว่างนิวเคลียสทั้งสองของอะตอมไฮโดรเจน
|
| รูปที่ 1-10แสดงออรฺบิทัลโมเลกุลของไฮโดรเจน ชนิดบอนดิง และชนิดแอนติบอนดิง |
ออร์บิทัลโมเลกุล คือ ขอบเขตในที่ว่างเปล่าที่กำหนดรูปร่างและขนาดโดยออร์บิทัลอะตอมที่รวมกันสองหรือมากกว่าสองอะตอมในโมเลกุล และบรรจุอิเล็กตรอนได้ 2 อนุภาค ออร์บิทัลโมเลกุลเกิดการซ้อนทับ (overlap) ของออร์บิทัลอะตอมสองหรือมากกว่าสองอะตอม การซ้อนทับเป็นพจน์ที่ใช้เมื่อ ส่วนของออร์บิทัลอะตอมครอบครองพื้นที่อันเดียวกันในที่ว่างเปล่า ถ้าระดับพลังงานของออร์บิทัลโมเลกุลต่ำ ( อยู่ตัวมาก ) กว่าออร์บิทัลอะตอม ออร์บิทัลโมเลกุลจะเป็นออร์บิทัลโมเลกุลชนิดบอนดิง อะตอมคู่นั้นอาจอยู่ตัว ถ้าแต่ละอะตอมใช้อิเล็กตรอนเรียงเดี่ยวเพื่อเกิดเป็นอิเล็กตรอนเรียงคู่ซึ่งครอบครองออร์บิทัลโมเลกุลชนิดบอนดิง รูปร่างออร์บิทัลโมเลกุลจะสอดคล้องกันรูปร่างพันธะโควาเลนท์ที่เกิดขึ้น
เนื่องจากออร์บิทัลโมเลกุลสร้างมาจากออร์บิทัลอะตอม ดังนั้นรูปร่างของออร์บิทัลโมเลกุลก็ขึ้นอยู่กับรูปร่างของออร์บิทัลอะตอมที่เป็นองค์ประกอบ เมื่อออร์บิทัลสร้างเป็นออร์บิทัลโมเลกุล ที่มีลักษณะเป็นทรงกลมหรือว่าเป็นเส้นเชื่อมระหว่างนิวเคลียสทั้งสองจะได้ ออร์บิทัลโมเลกุลที่เรียกว่าออร์บิทัล-ซิกมา( ) อักษร
) อักษร ในภาษากรีก สอดคล้องกับตัวอักษร S ซึ่งใช้สำหรับออร์บิทัลอะตอมที่เป็นทรงกลม อิเล็กตรอนในออร์บิทัล – ซิกมา เรียกว่าอิเล็กตรอน- ซิกมา(
ในภาษากรีก สอดคล้องกับตัวอักษร S ซึ่งใช้สำหรับออร์บิทัลอะตอมที่เป็นทรงกลม อิเล็กตรอนในออร์บิทัล – ซิกมา เรียกว่าอิเล็กตรอน- ซิกมา( - electron) และเรียกพันธะที่เกิดขึ้นว่าพันธะ- ซิกมา(
- electron) และเรียกพันธะที่เกิดขึ้นว่าพันธะ- ซิกมา( - bond)
- bond)
| รูปที่ 1-11แสดงระดับพลังงานในโมเลกุลไฮโดรเจน |
| รูปที่ 1-12แสดงการรวมออร์บิทัลอะตอมเป็นออร์บิทัลโมเลกุล(ก) แสดงออร์บิทัลโมเลกุลชนิดซิกมา (ข) แสดงออร์บิทัลโมเลกุลชนิดไพ |
โมเลกุลแก๊สไฮโดรเจนที่เรารู้จักกันแล้วว่าประกอบด้วยไฮโดรเจนสองอะตอมต่อกันด้วยพันธะโควาเลนท์ ออร์บิทัลโมเลกุลเกิดจากการซ้อนทับของออร์บิทัล 1S ของไฮโดรเจนแต่ละอะตอม การซ้อนทับของออร์บิทัลอะตอม 1S ทั้งสอง เกิดเป็นออร์บิทัลโมเลกุลชนิดซิกมาเกิดเป็นพันธะซิกมาขึ้นในโมเลกุลไฮโดรเจน
ในโมเลกุลแก๊สคลอรีน เป็นตัวอย่างที่แตกต่างไปจากโมเลกุลแก๊สไฮโดรเจนเล็กน้อย เราจะให้ความสนใจเฉพาะออร์บิทัลในเชลล์นอกของอะตอมคลอรีนซึ่งมีอิเล็กตรอนเรียงเดี่ยวอยุ่ในออร์บิทัล 3p ถ้าออร์บิทัล p ของคลอรีนสองอะตอมมาอยู่ในแนวแกนเดียวกัน และอะตอมเคลื่อนที่มาชิดกันเพียงพอที่จะซ้อนทับกัน จะเกิดออร์บิทัลโมเลกุล ชนิดบอนดิง ซึ่งเป้นออร์บิทัล-ซิกมา เกิดเป็นพันธะซิกมา ( ดูรูปที่ 1-13) รูปร่างออร์บิทัลของฮาโลเจนอื่น ๆ ก็คล้ายกับโมเลกุลคลอรีน
| รูปที่ 1-13 แสดงการรวมออร์บิทัล 2Pzของอะตอมคลอรีนเป็นออร์บิทัลโมเลกุลคลอรีน |
ถ้าออร์บิทัลอะตอม p มาซ้อนกันในแนวแกนขนานกัน ออร์บิทัลโมเลกุลที่เกิดขึ้นจะมีรูปร่างแตกต่างออกไป อิเล็กตรอนจะมีความหนาแน่นสองบริเวณ (ขอบเขต) คือ บริเวณทางด้านบนและด้านล่างนิวเคลียสทั้งสอง ( ดูรูป 1-12) ออร์บิทัลโมเลกุลชนิดนี้ เรียกว่าออร์ บิทัล-ไพ( - orbital) อิเล็กตรอนที่อยู่ในออร์บิทัล-ไพ เรียกว่าอิเล็กตรอน - ไพ(
- orbital) อิเล็กตรอนที่อยู่ในออร์บิทัล-ไพ เรียกว่าอิเล็กตรอน - ไพ( - electron) และพันธะที่เกิดขึ้นเรียกว่าพันธะ-ไพ(
- electron) และพันธะที่เกิดขึ้นเรียกว่าพันธะ-ไพ( - bond) ตัวอักษร
- bond) ตัวอักษร ใน ภาษากรีก สอดคล้องกับตัวอักษร p ที่ใช้กับออร์บิทัลอะตอม
ใน ภาษากรีก สอดคล้องกับตัวอักษร p ที่ใช้กับออร์บิทัลอะตอม
โมเลกุลที่คล้ายกันซึ่งประกอบด้วยพันธะไพ คือ โมเลกุลไนโตรเจน( N2) ในอะตอมไนโตรเจนมีอิเล็กตรอนมีอิเล็กตรอนเรียงเดี่ยวสามอนุภาคอยู่ในออร์บิทัล 2p ทั้งสามออร์บิทัล ดังนั้นออร์บิทัล p ทั้งสามจึงมีนัยสำคัญต่อโครงสร้างของออร์บิทัลโมเลกุล ไนโตรเจนสองอะตอมอาจเกิดพันธซิกมาหนึ่งพันธะจากการเกยเชื่อมของออร์บิทัล p ในแนวแกนเดียวกันกับนิวเคลียสของอะตอม ออร์บิทัล p อีกสองออร์บิทัลในแต่ละอะตอมจะเกิดพันธะในแนวแกนขนานกัน เกิดเป็นออร์บิทัลโมเลกุลชนิดไพ เนื่องจากมีออร์บิทัล p สองคู่ จึงเกิดออร์บิทัลโมเลกุลชนิดไพขึ้นสองออร์บิทัล ซึ่งวางตัวในแนวขนานกับระนาบ
อิเล็กตรอนรวม 6 อนุภาค จากออร์บิทัล p ทั้งสามของไนโตรเจนอะตอม จะเติมในออร์บิทัลโมเลกุลชนิดบอนดิงสามออร์บิทัล ( ซึ่งเป็นชนิดซิกมาหนึ่งออร์บิทัล และชนิดไพ สองออร์บิทัล ) ซึ่งสร้างมาจากออร์บิทัลอะตอม ดังนั้นโมเลกุลไนโตรเจนจึงประกอบด้วยพันธะโควาเลนท์สามพันธะ
| รูปร่างหมอกอิเล็กตรอนไพ ในโมเลกุลไนโตรเจนเป็นทรง กระบอกพันธะไพทั้งสองทำให้ความหนาแน่นของอิเล็กตรอนเป็น ทรงกระบอก คล้ายกับออร์บิทัล p ทั้งสามของเชลล์ย่อย ที่สร้าง เป็นเชลล์ย่อย ทรงกลมที่สมมาตร ดูรูปที่1-14 | |
| รูปที่ 1-14แสดงพันธะซิกมาและพันธะไพในโมเลกุลไนโตรเจน |
พันธะโควาเลนท์อาจเกิดระหว่างอะตอมของธาตุต่างชนิดกัน เช่น ในโมเลกุลของน้ำซึ่งเกิดจากไฮโดรเจนสองอะตอมและออกซิเจนหนึ่งอะตอม ออกซิเจนมีหมายเลขอะตอม 8 และมีการกระจายของอิเล็กตรอนในออร์บิทัลต่าง ๆ เป็น 1s2, 2s2,2p 2 x , 2p 1 y , 2p 1 Z มีอิเล็กตรอนเรียงเดี่ยวอยู่ในออร์บิทัล 2pyและ 2pZซึ่งแต่ละออร์บิทัล จะรวมกับออร์บิทัล 1 s ของไฮโดรเจน เกิดเป็นพันธะโควาเลนท์สองพันธะ เนื่องจากออกซิเจนรวมตัวไฮโดรเจนสองอะตอม จึงมีวาเลนซี เท่ากับ 2 หรือในโมเลกุลของแอมโมเนีย (NH 3 ) ไนโตรเจนมีหมายเลขอะตอม 7 และมีการกระจายของอิเล็กตรอนในออร์บิทัลต่าง ๆ เป็น 1 s 2 , 2s 2 ,2p 2 x , 2p 1 y , 2p 1 Z มีอิเล็กตรอนเรียงเดี่ยวในออร์บิทัล 2p x ,2p y และ 2p Z จึงสามารถรวมตัวกับไฮโดรเจนได้สามอะตอม เป็นแอมโมเนีย ไนโตรเจนจึงมีวาเลนซีเป็น 3
เนื่องจากออร์บิทัล p ทำมุมระหว่างกัน 90 0 เราจึงคาดคะเนว่ามุมพันธะระหว่าง H-O-H ในโมเลกุลน้ำ ควรเป็น 90 0 ด้วย แต่ความเป็นจริงซึ่งวัดได้จากการทดลองยืนยันว่ามุมนี้เป็น 104.5 0 ทั้งนี้เนื่องจากว่าพันธะระหว่าง O-H เป็นพันธะที่มีสภาพขั้วไฮโดรเจนทั้งสองซึ่งมีสภาพขั้วเหมือนกัน จึงเกิดแรงผลักซึ่งกันและกัน เป็นเหตุให้มุมของ H-O-H กางออกเกินกว่า 90 0 เป็น 104.5 0 ( ดูรูปที่ 1-15) ในทำนองเดียวกัน ในโมเลกุลแอมโมเนีย เราก็คาดคะเนว่ามุมระหว่าง H-N-H ควรเป็น 90 0 แต่ที่แท้กลับเป็น 107 0 และแอมโมเนียมีรูปทรงเรขาคณิตเป็นปีระมิด เหตุที่มุม H-N-H กางออกเป็น 107 0 อาจอธิบายได้โดยเหตุผลเดียวกับกรณีของน้ำ กล่าวคือ เกิดแรงผลักกันระหว่างอะตอมไฮโดรเจนซึ่งมีสภาพขั้วเป็นบวก ด้วยกัน
| รูปที่ 1-15แสดงการเกิดพันธะและแรงผลักระหว่างอะตอมไฮโดรเจนในโมเลกุลน้ำ |
ในอะตอมคาร์บอนสภาวะปกติ(ground state) การกระจายของอิเล็กตรอนเป็นดังนี้ 1s2, 2s2,มีอิเล็กตรอนเรียงเดี่ยวอยู่สองอนุภาค จึงรวมกับไฮโดรเจนได้สองอะตอม แต่โดยทั่วไปแล้วคาร์บอนแสดงวาเลนซีเป็น 4 เพราะว่าในสภาวะที่จะเข้าทำปฏิกริยา(excited state) อิเล็กตรอนอนุภาคหนึ่งของคาร์บอนที่อยู่ในออร์บิทัล 2 s จะถูกนำไปใช้ในออร์บิทัล 2p Z ทำให้การกระจายของอิเล็กตรอนเป็น 1s2, 2s2,ซึ่งมีอิเล็กตรอนเรียงเดี่ยวอยู่อนุภาค และรวมตัวกับไฮโดรเจนได้สี่อะตอมเป็นมีเธน (CH 4 ) พลังงานที่ได้จากการเกิดพันธะเพิ่มขึ้นอีกสองพันธะ มากเกินกว่าพลังงานที่จะใช้ในการดึงอิเล็กตรอนจาก ออร์บิทัล 2s ไปยังออร์บิทัล 2p Z ดังนั้นคาร์บอนในสภาพวาเลนซี 4 จึงอยู่ตัว
RETURN TO CONTENTS
บทเรียนที่ 5 ไฮบริไดเซชัน
ไฮบริไดเซชัน (hybridization) คือ ปรากฏการณ์ที่เกิดขึ้นเมื่อมีการผสมระหว่างอิเล็กตรอนในออร์บิทัลที่ต่างกันแต่อยู่ในเชลล์เดียวกัน อิเล็กตรอนที่ผสมกันนี้จะเกิดเป็นออร์บิทัลใหม่ที่มีสมบัติเหมือนกันทุกประการ และมีจำนวนเท่ากับออร์บิทัลต่าง ๆ ที่มีผสมกัน ไฮบริไดเซชันมีหลายชนิดด้วยกัน เช่น ไฮบริไดเซชันแบบ sp3, sp2,sp, d2sp3, dsp2, dsp3แต่ที่พบในสารประกอบคาร์บอนมีสามชนิด คือ ไฮบริไดเซชันแบบ sp3, sp2และ sp
1. ไฮบริไดเซชันแบบ sp3เกิดขึ้นเมื่อคาร์บอนถูกล้อมรอบด้วยอะตอมอื่นสี่อะตอม เช่น ในโมเลกุลของมีเธน ในมีเธนเราพบว่า คาร์บอนไม่ได้ใช้อิเล็กตรอนในสภาพ 1s2, 2s1,อิเล็กตรอนเรียงเดี่ยวทั้งสี่ออร์บิทัลจะผสมกันเกิดเป็นออร์บิทัลใหม่ขึ้นสี่ออร์บิทัล เรียกว่า ออร์บิทัล sp3ออร์บิทัล sp3ทั้งสี่มีคุณสมบัติและลักษณะเหมือนกันทุกประการคือ มีลักษณะและคุณสมบัติเป็นออร์บิทัล s ร้อยละ 25 ออร์บิทัล p ร้อยละ 75 และทำมุมระหว่างกัน 109 องศา 28 ลิปดา เนื่องจากเป็นการผสมกันระหว่างออร์บิทัล s หนึ่งออร์บิทัลและออร์บิทัล p สามออร์บิทัล จึงเรียกว่าไฮบริไดเซชันแบบ sp3จากนั้นไฮโดรเจนทั้งสี่อะตอมจะใช้อิเล็กตรอนในออร์บิทัล 1s เกยเชื่อมกับออร์บิทัล sp3ของคาร์บอน เกิดพันธะโควาเลนท์สี่พันธะ โดยมีคาร์บอนอยู่ตรงกลาง มีไฮโดรเจนสี่อะตอมอยู่ที่มุมทั้งสี่ของรูปเหลี่ยมสี่หน้า (tetrahedron) และพันธะแต่ละพันธะจะทำมุมกัน 109 องศา 28 ลิปดา ดังรูป 1-17 และ 1-19
รูปที่ 1-17แสดงการเกิดพันธะในมีเธน อิเล็กตรอนที่เข้าคู่ในแต่ละออร์บิทัลโมเลกุล เกิดจากการซ้อนทับของออร์บิทัล sp3ของคาร์บอน และออร์บิทัล 1s ของไฮโดรเจน
| (ก) | (ข) |
รูปที่ 1-16 แสดงการเกิดออร์บิทัล
(ก) แสดงรูปตัลออร์บิทัล sp3 (ข)แสดงชุดออร์บิทัล sp3ทั้งสี่ออร์บิทัล | ||
| รูปที่ 1-18ไดอะแกรมแสดงการเกิดไฮบริไดเซชันแบบ sp3ของอะตอมคาร์บอน |
| (ก) | (ข) | (ค) | ||||
รูปที่ 1-19หุ่นจำลองโมเลกุลมีเธน(ก) เส้นประคือแกนของออร์บิทัลโมเลกุล
(ข) หุ่นจำลองแบบลูกกลมและแกน( ball-strick ) (ค) หุ่นจำลองแบบสกาล( Scale ) แสดงหมอกอิเล็กตรอนในโมเลกุล
| ||||||
นอกจากนี้ อะตอมของคาร์บอนยังสามารถเกิดพันธะ ที่อยู่ตัวระหว่างกัน ได้อืกด้วย เช่นในโมเลกุลของอีเธน (ethane) โดยที่คาร์บอนแต่ละอะตอมใช้ออร์บิทัล sp3สามออร์บิทัลรวมกับไฮโดรเจน ที่เหลืออีกออร์บิทัลหนึ่งมารวมกันเองตามแนวแกนเดียวกัน เกิดพันธะซิกมา หนึ่งพันธะ พันธะระหว่างคาร์บอนทั้งสองอะตอมนี้ เรียกว่า พันธะเดี่ยว (single bond) ซึ่งสามารถหมุนได้รอบ และมีความยาวพันธะ 154 pm หรือ 1.54 อังสตรอม
| (ก) | (ข) | |||
| รูปที่ 1-20แสดงพันธะในโมเลกุลอีเธน | ||||
(ก) ออร์บิทัลโมเลกุลในอีเธน
(ข) แสดงการหมุนได้อย่างอิสระของพันธะซิกมาระหว่างคาร์บอน-คาร์บอน | ||||
2. ไฮบริไดเซชันแบบ sp2ในโมเลกุลเอทธิลีน (ethylene) อิเล็กตรอนเรียงเดี่ยวในออร์บิทัล 2s , 2pxและ 2pyของคาร์บอนแต่ละอะตอม จะผสมกันเกิดเป็นออร์บิทัลใหม่สามออร์บิทัล เรียกว่า ออร์บิทัล sp2ซึ่งมีสมบัติและลักษณะเป็นออร์บิทัล s ร้อยละ 33.3 ออร์บิทัล p ร้อยละ 66.7 และทำมุมระหว่างกัน 120 องศา ในแนวราบเดียวกัน แนวราบนี้จะตั้งฉากกับออร์บิทัล 2PZ เนื่องจากเป็นการผสมระหว่างอิเล็กตรอนในออร์บิทัล s หนึ่งออร์บิทัล และ p สองออร์บิทัล จึงเรียกว่า ไฮบริไดเซชันแบบ sp2คาร์บอนแต่ละอะตอมจะใช้ออร์บิทัล sp2สองออร์บิทัล รวมกับไฮโดรเจน ที่เหลืออีกออร์บิทัลหนึ่งรวมกันเองตามแนวแกนเดียวกัน เกิดพันธะซิกมาหนึ่งพันธะ ส่วนออร์บิทัล 2pzของคาร์บอนทั้งสองอะตอมซึ่งตั้งฉากกับพื้นราบของออร์บิทัล sp2จะเกยเชื่อมกันตามด้านข้างในแนวแกนขนานกัน เกิดพันธะไพขึ้นอีกพันธะหนึ่ง ดังรูป 1-22 ดังนั้น ในโมเลกุลของเอทธิลีน คาร์บอนทั้งสองอะตอมจะจับกันด้วยพันธะสองพันธะ คือ พันธะซิกมาและพันธะไพ รวมเรียกว่า พันธะคู่ (double bond) พันธะไพที่เกิดขึ้นจะมีผลในการดึงอิเล็กตรอนให้เข้าใกล้กันมาก จึงทำให้ระยะระหว่างคาร์บอนทั้งสองอะตอมสั้นลงเหลือ 134 pm หรือ 1.34 อังสตรอม และพันธะไพ ยังมีผลทำให้พันธะคู่ตรึงอยู่กับที่ไม่สามารถหมุนได้อย่างพันธะเดี่ยว
| รูปที่ 1-21 แสดงการเกิดไฮบริไดเซชันแบบ sp2ของอะตอมคาร์บอน |
| รูปที่ 1-22 แสดงการเกิดพันธะซิกมาในเอทธิลีน ( รูปนี้ไม่ได้แสดงออร์บิทัล 2pz) |
| (ก) | (ข) | (ค) | |
| รูปที่ 1-23แสดงออร์บิทัล sp2ของคาร์บอนในเอทธิลีน(ก)แสดงรูปตัดของ ออร์บิทัล sp2(ข) ออร์บิทัล sp2ทั้งสามของคาร์บอนซึ่งอยู่ในระนาบเดียวกัน(มองจากด้านบน) (ค) ภาพรวมของคาร์บอนในสภาวะที่เกิดไฮบริไดเซชันแบบ sp2(รูปนี้ไม่ได้แสดงออร์บิทัล 2pz) | |||
| รูปที่ 1-24แสดงการเกิดพันธะไพ | |
| (ก) สภาพก่อนที่ออร์บิทัล pzจะซ้อนทับกันพันธะซิกมาทั้งหมดเกิดตามรูป 1-22 (ข) ออร์บิทัล pzซ้อนทับกันแล้ว (ค) แสดงพันธะซิกมาหนึ่งพันธะซึ่งแสดงด้วยเส้นหนาและพันธะไพหนึ่งพันธะรวมเป็นพันธะคู่ระหว่างคาร์บอน | |
3. ไฮบริไดเซชันแบบ spในโมเลกุลของอะเซทิลีน(acetylene) คาร์บอนแต่ละอะตอมเกิดไฮบริไดเซชันแบบ sp คือ ออร์บิทัล s รวมกับออร์บิทัล p เพียง 1 ออร์บิทัล ทำให้เกิดออร์บิทัล sp ขึ้นสองออร์บิทัลซึ่งทำมุมระหว่างกัน 180 องศา หรืออยู่ในแนวเส้นตรงเดียวกันในแนวเดิมของออร์บิทัล p ซึ่งตั้งแากกับออร์บิทัล p ที่เหลืออีกสองออร์บิทัล จากนั้นคาร์บอนแต่ละอะตอมจะใช้ออร์บิทัล sp อันหนึ่งรวมกันตามแนวแกนเป็นพันธะซิกมา และใช้ออร์บิทัล sp อีก ออร์บิทัลหนึ่ง รวมกับไฮโดรเจน คาร์บอนแต่ละอะตอมจะเหลือ ออร์บิทัล p ซึ่งจะมารวมกันเองตามด้านข้างในแนวแกนขนานกัน เกิดเป็นพันธะไพขึ้นอีกสองพันธะ รวมกันออกมาเป็นรูปทรงกระบอก ดังแสดงในรูป 1-26 เราเรียกพันะะระหว่างคาร์บอนนี้ว่าพันธะสาม(triple bond) ซึ่งมีความยาว 120 pm หรือ 1.20 อังสตรอม และหมุนไม่ได้
| รูปที่ 1-25แสดงการเกิดไฮบริไดเซชันแบบ sp ของคาร์บอน |
| (ก) | (ข) | |||
| (ค) | ||||
| รูปที่ 1-26แสดงพันธะสามในอเซทิลีน (ก) แสดงออร์บิทัล sp ทั้งสองออร์บิทัล ออร์บิทัล pxและpyของคาร์บอน (ข) แสดงพันธะซิกมาของอะเซทิลีน s-sp, sp-sp และsp-s จากซ้ายไปขวา ตามลำดับ (ค) แสดงพันธะไพของอะเซทิลีนซึ่งเกิดจากการซ้อนทับทางด้านข้างของ pxกับ pyกับ pzเกิดเป็นพันธะไพสองพันธะ |
RETURN TO CONTENTS
บทเรียนที่ 6 รูปร่างโมเลกุล
รูปร่างโมเลกุลโคเวเลนต์
รูปร่างโมเลกุลโคเวเลนต์ขึ้นอยู่กับ ทิศทางของพันธะโคเวเลนต์ , ความยาวพันธะ , และมุมระหว่างพันธะโคเวเลนต์รอบอะตอมกลาง
ทิศทางของพันธะขึ้นอยู่กับ
- แรงผลักระหว่างพันธะรอบอะตอมกลาง เพื่อให้ห่างกันมากที่สุด
-แรงผลักของอิเล็กตรอนคู่อิสระของอะตอมกลางที่มีต่อพันธะรอบอะตอมกลางแรงนี้มีค่ามากกว่าแรงที่พันธะผลักกันเอง
รูปร่างโมเลกุลโคเวเลนต์ที่ควรรู้จัก
1.รูปร่างเส้นตรง(Limear) โมเลกุล BeCl2และสูตรโครงสร้างดังนี้
อะตอมกลาง Be ในโมเลกุล BeCl2มีอิเล็กตรอนทั้งหมด 2 ตัว และทั้ง 2 ตัวเป็นอิเล็กตรอนคู่ร่วมพันธะ ซึ่งจะผลักกันให้ห่างกันให้มากที่สุด ทำให้โมเลกุลเป็นรูปเส้นตรง มีมุมระหว่างพันธะ 180๐ดังรูป
โมเลกุล CO2มีสูตรโครงสร้างดังนี้
อะตอมกลาง C ในโมเลกุล CO2มีเวเลนต์อิเล็กตรอน 4 ตัว และทั้ง 4 ตัวเป็นอิเล็กตรอนคู่ร่วมพันธะ(เกิดพันธะคู่กับอะตอม O 2 พันธะ) ทำให้เกิดแรงผลักกันระหว่างพันธะให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปเส้นตรง มีมุมระหว่างพันธะ 180๐ดังรูป
สรุปโมเลกุลของสารโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 2 พันธะ จะเป็นพันธะชนิดใดก็ได้ และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็นเส้นตรง
2. รูปร่างสามเหลี่ยมแบนราบ(Trigonal planar)
โมเลกุล BCl3มีสูตรโครงสร้าง ดังนี้
อะตอมกลาง B ในโมเลกุล BCl3มีเวเลนต์อิเล็กตรอน 3 ตัว และเป็นอิเล็กตรอนคู่ร่วมพันธะทั้งหมด (สร้างพันธะเดี่ยวกับอะตอม Cl 3 พันธะ) พันธะผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปสามเหลี่ยมแบนราบ มีมุมระหว่างพันธะเป็น 120๐ดังรูป
สรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 3 พันธะ (ไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น สามเหลี่ยมแบนราบ
3. รูปร่างทรงสี่หน้า
โมเลกุลมีเธน CH4มีสูตรโครงสร้างดังนี้
อะตอม C ในโมเลกุล CH4มีเวเลนต์อิเล็กตรอน 4 ตัว และเป็นอิเล็กตรอนคู่ร่วมพันธะทั้งหมด (สร้างพันธะเดี่ยวกับอะตอม H 4 พันธะ) เกิดการผลักกันระหว่างพันธะเพื่อให้ห่างกันมากที่สุด ทำให้โมเลกุลมีรูปร่างเป็นรูปทรงสี่หน้า มีมุมระหว่างพันธะเป็น 109.5๐ดังรูป
สรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 4 พันธะ (โดยไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น ทรงสี่หน้า
4. รูปร่างพีระมิดฐานสามเหลี่ยม(Trigonal bipyramkial)
โมเลกุล PCl5มีสูตรโครงสร้างดังนี้
อะตอมของ P ในโมเลกุล PCl5มีเวเลนต์อิเล็กตรอน = 5 สร้างพันธะเดี่ยวกับอะตอมของ Cl ทั้ง 5 ต้ว ไม่มีอิเล็กตรอนคู่โดดเดี่ยว พันธะผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลมีรูปร่างพีระมิดคู่ฐานสามเหลี่ยม มีมุมระหว่างพันธะเป็น 120๐และ 90๐ดังรูป
5. ทรงแปดหน้า(Octahedral)
โมเลกุล SF6 มีสูตรโครงสร้างดังนี้
อะตอมของ S มีเวเลนต์อิเล็กตรอน = 6 อิเล็กตรอนทั้ง 6 ตัวสร้างพันธะเดี่ยวกับอะตอมของ F ทั้ง 6 ตัว (ไม่มีอิเล็กตรอนคู่โดดเดี่ยว) อิเล็กตรอนคู่ร่วมพันธะ(พันธะ) เกิดการผลักกันให้ห่างกันมากที่สุด จึงทำให้มีรูปร่างโมเลกุลเป็นรูปทรงแปดหน้า มีมุมระหว่างพันธะ 90๐ดังรูป
สรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 6 พันธะ (ไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว รูปร่างโมเลกุลเป็น ทรงแปดหน้า
อิเล็กตรอนคู่โดดเดี่ยวกับรูปร่างโมเลกุล
ตามปกติอิเล็กตรอนแต่ละคู่จะออกแรงผลักกัน แรงผลักของอิเล็กตรอนแต่ละคู่จะไม่เท่ากัน ซึ่งสามารถเขียนแรงผลักระหว่างอิเล็กตรอนคู่ต่างๆ จากมากไปหาน้อยได้ดังนี้ อิเล็กตรอนคู่โดเดี่ยวกับอิเล็กตรอนคู่โดดเดี่ยว > อิเล็กตรอนคู่โดดเดี่ยวกับอิเล็กตรอนคู่ร่วมพันธะ > อิเล็กตรอนคู่ร่วมพันธะกับอิเล็กตรอนคู่ร่วมพันธะ
6. รูปร่างพีระมิดฐานสามเหลี่ยม
โมเลกุล NH3มีสูตรโครงสร้างดังนี้
อะตอม N ในโมเลกุล NH3มีเวเลนต์อิเล็กตรอน = 5 สร้างพันธะเดี่ยวกับอะตอมของ H 3 พันธะเหลืออิเล็กตรอนไม่ได้ร่วมพันธะ 1 คู่(อิเล็กตรอนคู่โดดเดี่ยว) อิเล็กตรอนทั้ง 4 คู่รอบอะตอมกลาง ( N ) จะผลักกันให้ห่างกันมากที่สุด แต่เนื่องจากแรงผลักระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอิเล็กตรอนคู่ร่วมพันธะ มีค่ามากกว่าแรงผลักระหว่างอิเล็กตรอนคู่ร่วมพันธะผลักกันเอง จึงทำให้มุมระหว่างพันธะ H – N ลดลงเหลือ 107๐และรูปร่างโมเลกุลเป็น รูปพีระมิดฐายสามเหลี่ยม ดังรูป
7. รูปร่างมุมงอ
โมเลกุล H2O มีสูตรโครงสร้างดังนี้
อะตอมกลาง O ในโมเลกุลของ H2O มีเวเลนต์อิเล็กตรอน = 6 สร้างพันธะเดี่ยวกับอะตอมของ H 2 พันธะ จึงมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ (4 ตัว) ซึ่งอิเล็กตรอนคู่โดดเดี่ยว 2 คู่นี้ จะมีแรงผลักอิเล็กตรอนคู่ร่วมพันธะ มากกว่าแรงผลักกันของอิเล็กตรอนคู่ร่วมพันธะ ทำให้มุมระหว่างพันธะ H – O – H มีค่าลดลงเหลือ 105๐รูปร่างโมเลกุลจึงไม่เป็นเส้นตรง แต่เป็นรูปมุมงอหรือตัววี
อ้างอิง
ความคิดเห็น
แสดงความคิดเห็น